

目的:肠道菌群被认为在自闭症谱系障碍(ASD)中发挥作用。我们假设,ASD患儿携带着一种与典型发育(TD)儿童有所不同的肠道菌群发育特征。在这里,我们旨在表征与年龄相关的ASD患儿肠道菌群的组成和功能变化,并鉴定新的预测ASD的粪便细菌标志物。
设计:我们对146名中国儿童(72名ASD和74名TD儿童)的粪便样本进行了深度宏基因组测序。我们比较了ASD患儿和TD儿童之间的肠道微生物组成和功能。通过宏基因组分析确定和验证了候选细菌标志物。利用随机森林模型评估了肠道菌群发育与年龄的关系。
结果:ASD和年龄对儿童的粪便菌群组成产生了最显著和最大的影响,而饮食与之无相关性。与TD儿童相比,ASD患儿的粪便菌群组成显著改变,表现为细菌丰富度增加(p=0.021)和菌群组成改变(p<0.05)。鉴定了五种细菌物种来区分ASD和TD儿童的肠道微生物,其在发现队列和验证队列中的受试者工作特征曲线下面积(AUC)分别为82.6%和76.2%。与TD儿童相比,ASD患儿的肠道微生物组中多个神经递质合成相关途径被耗竭(p<0.05)。在TD儿童中观察到的与年龄相关的生长相关肠道细菌(年龄判别物种)发展动态在ASD患儿中跨越早期生命年龄范围内丧失。 结论:与TD儿童相比,中国ASD患儿的肠道微生物组成、生态网络和功能发生了变化。我们鉴定了预测ASD的新的细菌标志物,并证明了ASD患儿肠道菌群的持续低发育,滞后于其相应年龄匹配的同龄人。

自闭症谱系障碍(ASD)是一组在早期出现的神经发育状况,其特征为受损的社交沟通和互动能力以及刻板、重复的行为。亚洲儿童和青少年的ASD患病率为0.36%,而西方国家为1.85%。在过去的二十年中,中国ASD的发病率从2000年的每10,000人中的2.80增加到2015年的每10,000人中的63。遗传研究强调了ASD中的新生突变的重要性,但尚未发现单个基因会显著增加ASD的风险。除了遗传因素外,肠道菌群被认为在ASD中发挥作用。胃肠道(GI)道中的微生物群已被证实通过多种途径(包括免疫激活、微生物代谢产物和肽的生成以及各种神经递质和神经调节剂的生成)影响大脑生理和社会行为。在早期童年的行为和生物发展阶段,肠道微生物被认为在发育中至关重要,通过辅助能量代谢和调节免疫系统。Subramanian等人之前描述了健康儿童中随年龄成熟的肠道细菌组合,以及营养不良儿童相对“不成熟”的微生物组成。除了生物学上的未成熟外,还发现肠道菌群的发展与认知发展密切相关。ASD中细菌α多样性的年龄相关变化已被报道,但ASD中肠道菌群的发展轨迹尚未报告。微生物成熟度可能提供了儿童发育的微生物测量作为分类健康或疾病状态的一种方式,并为疾病的发生、进展和治疗提供新的见解。考虑到肠道菌群已通过肠-脑轴与大脑功能联系在一起,我们假设肠道菌群的低发育可能与ASD有关。
目前,诊断ASD可能具有挑战性,因为没有明确的医学测试,诊断基于医生的评估。因此,用于预测ASD的潜在粪便细菌生物标志物可以促进早期治疗和干预。我们发现ASD患儿的肠道微生物组与典型发育(TD)儿童相比存在明显变化,并确定了可能作为ASD非侵入性生物标志物的五种细菌物种标志物候选者。我们进一步表明,与年龄相匹配的TD同龄人相比,ASD患儿的肠道微生物组的发育落后于年龄,表明ASD患儿的肠道微生物组低发育相对于TD儿童。

ASD和年龄是影响儿童肠道微生物组成的最重要因素
总共从社区招募了64名3至6岁被诊断为ASD的学龄前儿童,以及与儿童年龄(在6个月内)和性别匹配的64名典型发育(TD)的学龄前儿童(表1,(在线补充表S1)。我们首先检查了宿主因素与儿童粪便菌群组成之间的关联。在检查的宿主因素中,根据效应大小,年龄、ASD和身体质量指数(BMI)与粪便菌群组成显示出最大的关联(在线补充图S1A,图1A,基于排列多元方差分析(PERMANOVA),虚假发现率(FDR)<0.05)。饮食与肠道菌群组成无关。在这些主要因素中,ASD、年龄和BMI对肠道菌群的影响彼此独立(在线补充图S1B,在线补充表S2)。为进一步探讨宿主因素如何影响肠道菌群组成,我们调查了个体宿主因素与检测到的细菌种类之间的相关性。19种细菌物种与ASD、年龄、性别、母乳喂养时长(月)、饮食质量、分娩方式和胎龄呈显著相关(MaAslin,图1B)。不明阿利斯蒂皮菌(Alistipes indistinctus)、候选TM7c与ASD呈正相关(在ASD组中丰度明显高于TD,图1B)。梭菌科细菌与3天饮食质量呈正相关。甲状结肠弯曲杆菌(Parabacteroides merdae)在经剖宫产儿童中减少,与经阴道分娩相比,并且无论分娩方式如何,这种物种在ASD患儿中均减少(曼-惠特尼U检验,p<0.05,在线补充图S1C)。总的来说,我们的数据表明,年龄、ASD和BMI是与该队列中肠道菌群变异最相关的主要因素。
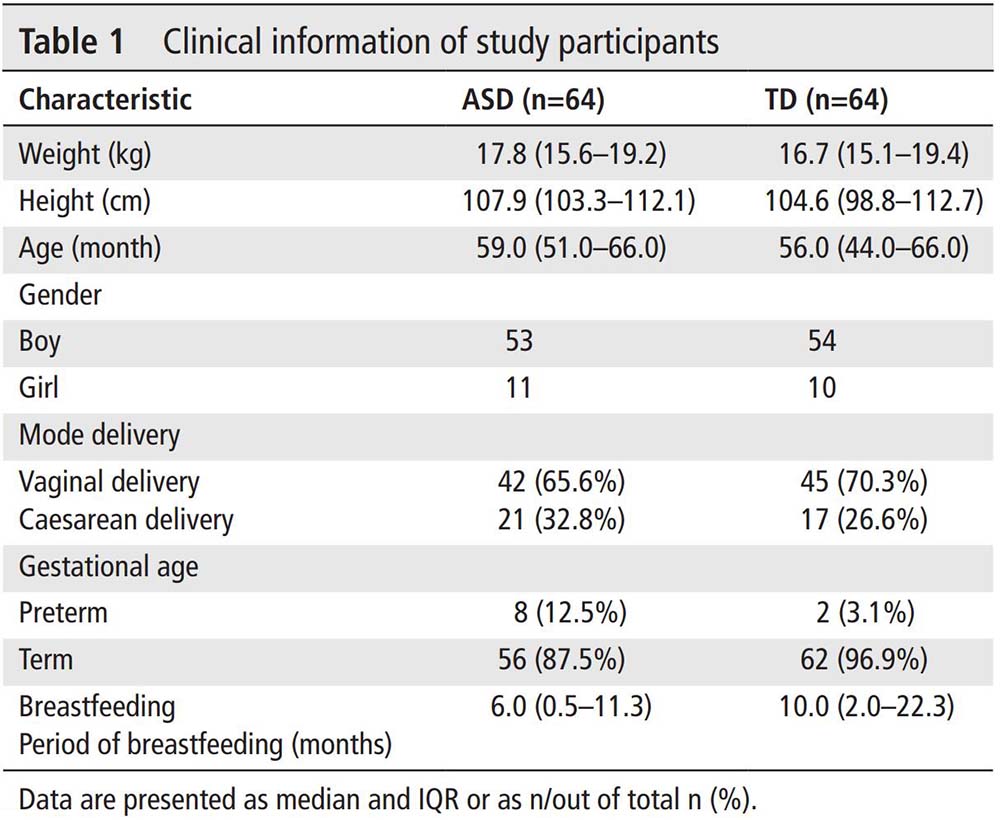
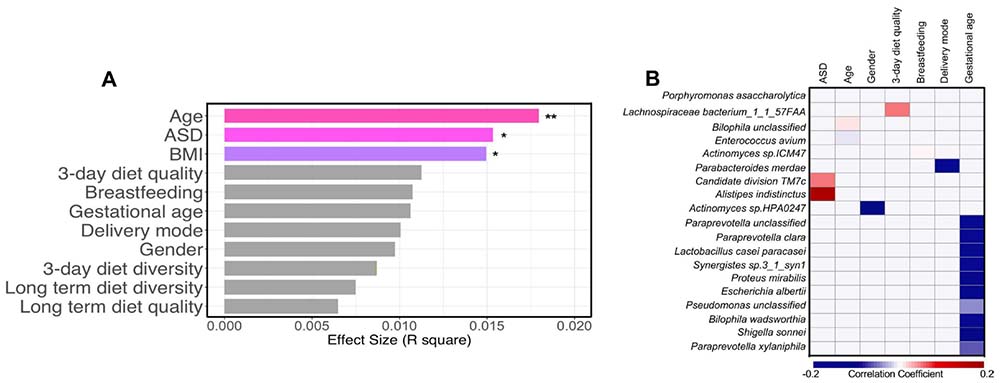
图1 宿主因素对儿童肠道菌群的影响。
(A) 通过多元分析确定宿主因素对儿童肠道菌群变异的效应大小。效应大小和统计学显著性通过adonis函数进行PERMANOVA确定。只有显著的宿主因素被着色,调整p值被记录。*P<0.05,**p<0.01。(B) 宿主因素与肠道细菌物种之间的相关性热图。相关系数通过MaAslin计算。仅绘制统计学上显著的相关性(FDR<0.1)。底部条的颜色强度与相关系数成正比,蓝色表示负相关,红色表示正相关。ASD,自闭症谱系障碍;BMI,身体质量指数。
鉴定粪便细菌物种作为ASD的潜在生物标志物
自闭症谱系障碍(ASD)患儿的微生物丰富度高于与年龄和BMI匹配的典型发育(TD)儿童(t检验,p<0.05,图2A)。在属水平上,克雷伯菌属(Clostridium)、二氏菌属(Dialister)和假肠杆菌属(Coprobacillus)等属在ASD患儿中富集,而已知产丁酸的粪链球菌属(Faecalibacterium)明显减少(在线补充图S2B,在线补充表S3,FDR<0.05)。在物种水平上,与TD相比,ASD患儿的肠道菌群组成明显不同(图2B,基于Bray-Curtis差异的PERMANOVA,p<0.05)。此外,与TD相比,ASD患儿的肠道菌群更加异质,表现为ASD患儿的个体间菌群差异显著增加(Bray-Curtis差异,t检验,p<0.0001)。这些物种水平的组成差异主要归因于五种细菌物种,包括不明阿利斯蒂皮菌(Alistipes indistinctus)、候选分部_TM7_分离物_TM7c、克里斯塔氏链球菌(Streptococcus cristatus)、利莫翁长梭菌(Eubacterium limosum)和寡糖链球菌(Streptococcus oligofermentans)(通过随机森林(RF)通过10折交叉验证识别,图2C)。利用这五个分类单元,RF模型在区分ASD患儿和TD儿童方面返回了82.6%的曲线下面积(AUC)值。为了验证生物标志物,我们从一个独立的儿童队列中获得了粪便基因组,该队列由来自香港不同社区来源的八名ASD患儿和十名TD儿童组成(验证集)。在这个验证队列中使用相同的五个生物标志物进行RF分类显示出76.2%的AUC(图2D)。这些结果表明,TD儿童和ASD患儿之间肠道菌群组成的差异可以作为一种非侵入性的ASD筛查工具。
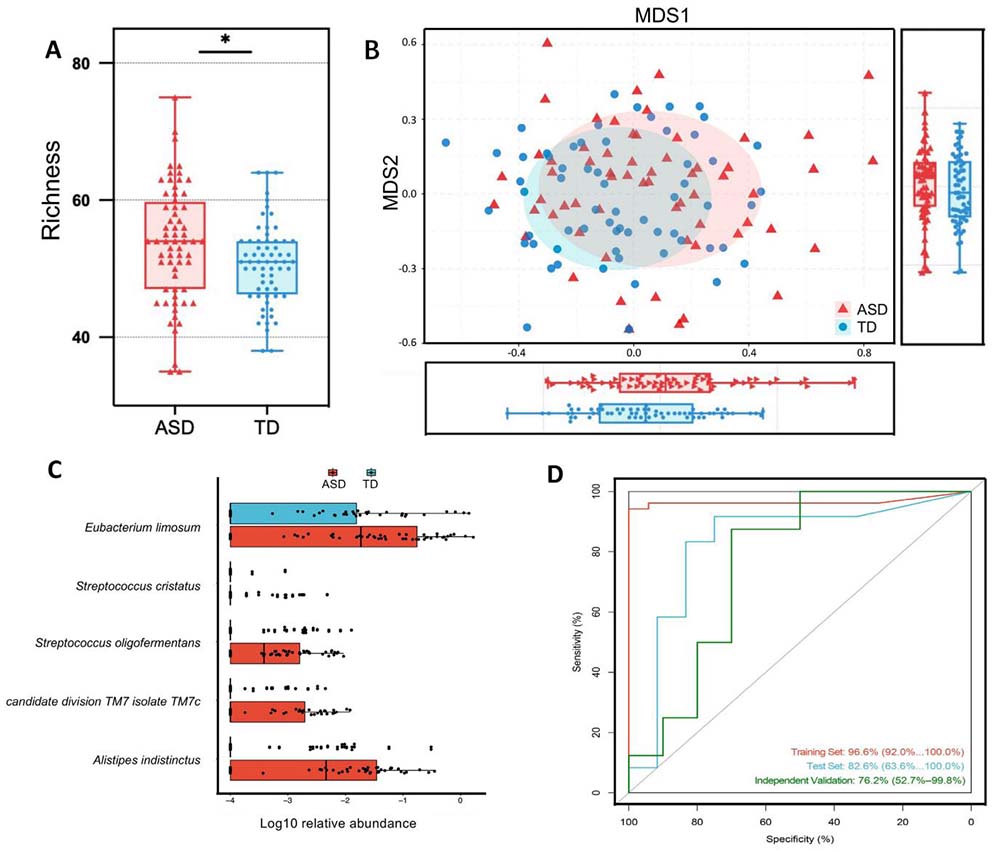
图2 中国ASD患儿肠道菌群的变化。
(A) ASD患儿和TD儿童之间粪便细菌属的丰富度比较。对于箱线图,箱体延伸从第一到第三四分位数(25%至75%分位数),中位数由水平线表示。ASD组和TD组之间的统计学显著性由t检验确定,*p<0.05。(B) 基于Bray-Curtis差异的ASD组和TD组细菌群落组成的NMDS(非度量多维尺度),统计学显著性由PERMANOVA确定,p<0.05。(C) ASD和TD之间5种细菌物种相对丰度的比较。这五种细菌物种标记由随机森林和10倍交叉验证确定。(D) 用于分类ASD与TD肠道菌群的随机森林分类器性能。接收器操作特征曲线描述了在不同分类严格度下随机森林分类器真正和假正例率之间的权衡。红色、蓝色和绿色线分别表示训练集、测试集和验证集的AUC值。ASD,自闭症谱系障碍;RF,随机森林;TD,典型发育。
ASD患儿与TD儿童的肠道细菌生态网络对比
为了理解TD儿童和ASD患儿肠道菌群中细菌之间的潜在关系,我们通过评估它们相对丰度的两两Spearman等级相关性来评估检测到的细菌物种之间的生态相互作用。在ASD和TD中,大多数相关性都是正相关的(图3),表明生态系统主要由微生物间的合作而不是竞争所主导。与TD相比,ASD患儿观察到了更强的相关网络,这表现在显著相关性的数量(671对368)和系数上(图3,FDR<0.05,|相关系数|>0.5)。在TD儿童中,属于厚壁菌门(Firmicutes)的细菌展示了最多的种间相互作用,乳杆菌属(Lactobacillus)在细菌相互作用中显示出关键和中心作用。如图3所示,拟杆菌门(Bacteroidetes)在ASD患儿的生态网络中显示出强健的相关性,并占据了中心位置。拟杆菌属的相关性较高的物种在ASD患儿中较多(相互作用数>10)。拟杆菌属的物种与神经退行性疾病的发展有关。此外,ASD中富集的几种梭菌属(Clostridium)密切相互作用,并在ASD中形成一个连接的群体。梭菌属的物种通过产生梭菌毒素与ASD相关联,该毒素对中枢神经系统有病理学影响。肠道菌群生态网络的这些变化表明,在ASD患儿中,种间通讯或相互作用显著改变。
图3 ASD患儿与TD儿童肠道细菌间的生态网络。
分别为ASD和TD中细菌-细菌在物种水平上的相关性。通过Spearman等级相关分析计算了分类群之间的相关性。对所有两两比较确定了统计学显著性。仅绘制了统计学上显著的相关性(FDR <0.05),其|相关系数| >0.5。通过Cytoscape(3.8.1)可视化了相关网络。节点大小与单个微生物物种的显著种间相关数成正比。节点的颜色表示相应微生物物种所属的门。连接线的颜色强度与相关系数成正比,蓝色线表示负相关,红色线表示正相关。ASD,自闭症谱系障碍;TD,典型发育。
与神经递质生物合成相关的途径在ASD患儿的肠道菌群中减少
使用HUMAnN2评估了ASD患儿肠道菌群的功能性,与其组成性变化相关或有关的功能性。与TD儿童相比,ASD患儿的肠道菌群中与神经递质生物合成相关的途径显著减少(曼-惠特尼U检验,图4A)。涉及赤霉素生物合成(ARO-PWY)和PWY-6163的途径(赤霉素生物合成的前体)在ASD患儿的肠道菌群中与TD儿童相比显著减少。同时,与芳香族氨基酸生物合成相关的COMPLETE-ARO-PWY功能(包括L-色氨酸、L-酪氨酸)也在ASD中减少。此外,相对于TD儿童,ASD患儿的微生物甘氨酸(抑制性神经递质)生物合成途径和谷氨酸合成酶(由微生物基因编码的制造谷氨酸的酶)的丰度也有所减少(在线补充图S3B)。种类Ruminococcus sp. 5_1_39BFAA、Eubacterium rectale和Ruminococcus bromii,Faecalibacterium prausnitzii分别是L-色氨酸和甘氨酸生物合成的主要贡献者(图4B、C),而Faecalibacterium在ASD中也显示出较低的丰度。值得注意的是,与TD儿童相比,Faecalibacterium prausnitzii对丝氨酸-甘氨酸代谢的贡献在ASD患儿中显著减少(在线补充图S3A)。总的来说,我们的数据显示,与神经递质合成相关的微生物组功能在ASD患儿中显著减少,这可能对ASD中的精神异常产生深远的功能后果。由于神经递质使信号跨越突触传递到神经元,在突触功能失调被认为是导致ASD病理生理的因素之一,这些结果表明肠道微生物在ASD中的作用与氨基酸代谢有关。
基于研究对象的肠道菌群功能性档案和临床参数,我们通过MaAslin探索了肠道菌群功能模块的丰度与宿主因素之间的关系。我们发现年龄是与微生物功能途径显著相关的唯一因素(在线补充表S4,FDR<0.1)。在这些关联中,细胞结构生物合成和嘌呤核苷酸生物合成途径随着年龄的增长而减少。因此,年龄对儿童肠道菌群的功能性产生影响。
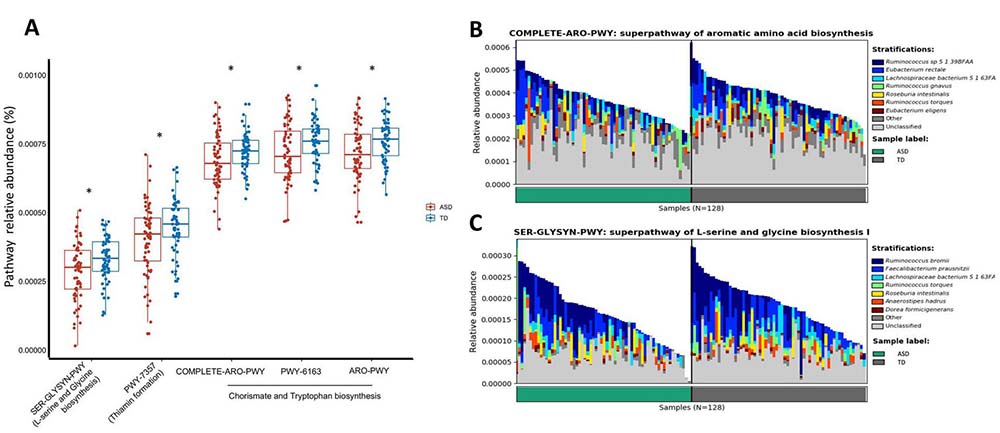
图4 ASD患儿肠道菌群的功能性变化。
(A) 与神经递质生物合成相关的途径在ASD患儿与TD儿童中的丰度比较。显著性由Welch t检验确定,标注为*p<0.05。 (B) 和 (C) 显示ASD患儿和TD儿童肠道菌群中与芳香族氨基酸和L-丝氨酸和甘氨酸生物合成相关的途径。在每个功能模块中,肠道中的生物合成由一组物种(每个叠加的条形图块)贡献,每个叠加的条形图代表一个受试者的宏基因组。ASD,自闭症谱系障碍;TD,典型发育。
ASD患儿肠道菌群发育异常
考虑到宿主年龄对肠道菌群组成和功能的影响,我们假设与TD儿童相比,ASD患儿的肠道菌群发育方式不同。我们使用随机森林模型对TD儿童的微生物群落的相对丰度与TD儿童在粪便样本采集时的年龄进行回归,来建模TD儿童的微生物发育过程。结果,我们确定了26种与年龄相关的细菌物种(图5A),作为儿童肠道菌群随年龄典型发展的代理物种(图5B,左图)。与TD儿童相比,在ASD患儿中,这些分类群的丰度受到严重干扰,并且与年龄没有相关性(图5B,右图)。例如,在TD儿童中,Eubacterium limosum和Bifidobacterium breve的相对丰度随年龄减少,而Eubacterium brachy、Haemophilus parainfluenzae、Bacteroides cellulosilyticus和梭菌属(Lachnospiraceae bacterium)3_1_46FAA的相对丰度随年龄增加(图5B,左图)。在ASD患儿中这些关联消失(图5B,右图),表明在早期生长过程中肠道菌群发育异常。
为了验证我们的发现,我们基于26种年龄判别物种的丰度,开发了一个稀疏微生物组-年龄预测模型,作为TD儿童年龄的函数(图5C)。在TD儿童中,预测的微生物组年龄随年龄线性增加,说明肠道微生物组随着年龄的增长呈现稳定的发展趋势。然而,当我们将在TD儿童中开发的微生物组-年龄模型用于预测ASD患儿的微生物组年龄时,我们发现ASD患儿的肠道微生物组未能与宿主的年龄同步发展,这表现为相对于TD儿童更平缓的斜率(线性模型的斜率分别为0.10和0.31,图5C)。这些数据共同表明,ASD患儿在儿童成长过程中其肠道微生物组发育受损。肠道微生物组与儿童共同进化,建立了一种共生和共生的关系,儿童时期肠道微生物组的异常发育可能对宿主健康产生长期影响。
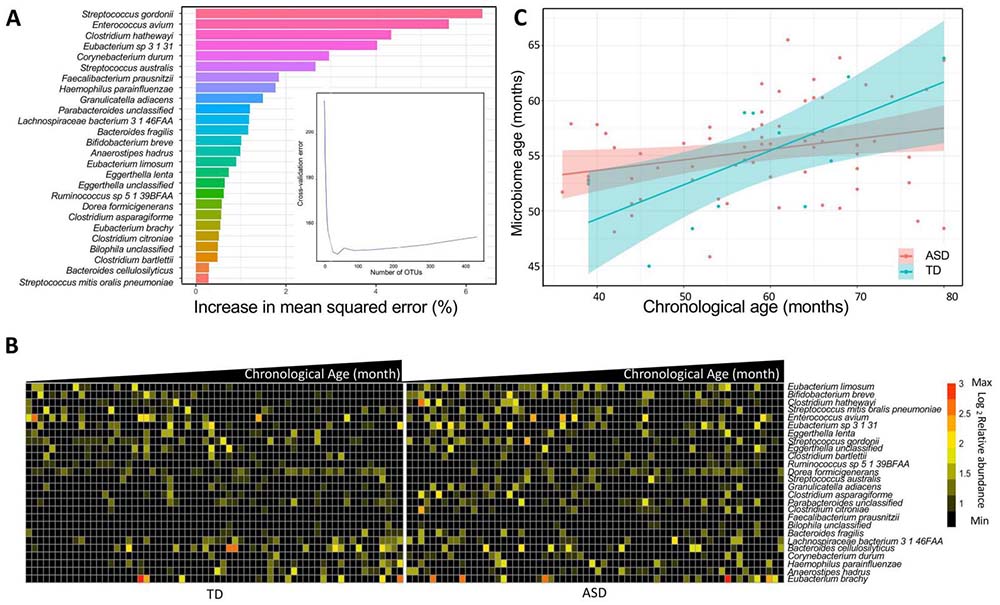
图5 ASD患儿中年龄判别性物种的发育不足。
(A) 通过在TD受试者中将粪便细菌物种的相对丰度与宿主年龄进行随机森林回归,确定了26种被识别为年龄判别性细菌分类群。这些年龄判别性物种按照它们对模型准确性的重要性降序排列。重要性是根据在相对丰度值被随机排列时微生物组年龄预测均方误差的百分增加来确定的。插图显示了五倍10倍交叉验证误差与输入细菌物种数量的关系(蓝线)。(B) 26种年龄判别性细菌分类群的相对丰度热图,分别绘制在TD和ASD儿童的年龄谱(月)上。(C) ASD患儿与TD儿童中肠道菌群的发育不足。肠道微生物组年龄预测模型建立为TD儿童的生物年龄函数,并用于根据ASD患儿的实际年龄预测其微生物组年龄。ASD,自闭症谱系障碍;TD,典型发育。

据我们所知,本研究代表了中国人群中ASD患儿和TD儿童肠道菌群研究中最深入的研究。通过整合肠道菌群的组成和功能与儿童特征的关联,我们展示了与年龄相关的异常发育以及ASD患儿肠道菌群中功能失调。值得注意的是,潜在的病原体,如梭菌属和不明显Alistipes在ASD患儿中富集,而Faecalibcterium则被低估。据报道,梭菌属通过产生梭菌毒素与脑组织损伤和神经系统疾病相关,这可能在儿童发育期间扭曲树突丛的复杂性。此外,意大利队的一项研究表明,梭菌属的相对丰度在ASD患儿中较高,表明它们的富集可能在不同地理区域中普遍存在。然而,各种族群和研究中对ASD患儿相关的肠道微生物分类存在巨大的差异。相反,一项日本的研究显示,Faecalibcterium属在ASD患儿中更丰富。同样,在欧洲的一项研究中,与我们的中国队列相比,Alistipes的丰度在ASD患儿中较低。这与其他研究类似,其中地理因素被描述为肠道菌群变异的关键因素。考虑到地理位置和人口特征与饮食、环境和生活方式密切相关,这些因素可能影响儿童肠道菌群的变异。
广泛的研究表明,饮食在塑造肠道菌群中发挥着作用。碳水化合物、蛋白质和脂肪等营养物质为肠道菌群提供了能量。ASD患儿表现出重复行为和受限制的兴趣等症状,这可能影响其饮食习惯,从而导致营养不足。因此,TD和ASD患儿之间的饮食差异可能会影响肠道菌群组成的比较。为了解决本研究中受调查儿童之间可能存在的饮食差异,我们考虑了年龄、性别和BMI等其他参数,评估了其膳食摄入与肠道菌群组成之间的关联。结果显示,饮食对肠道菌群的变异没有显著影响(图1A,在线补充图1A),表明在这个队列中,饮食不太可能是一个混杂因素。
肠道菌群的生态网络被认为对宿主的健康和福祉至关重要,因为它显示了有益的共生体及其相关功能随时间的维持。已经描述了在炎症性肠病和抑郁症中出现的改变的细菌网络,这两种情况都以破坏的相关网络和关键细菌的扰动为特征。在我们的研究中,ASD患儿的肠道微生物群显示出更复杂的生态网络,其中观察到更多的细菌种间相互作用。显示高度合作的微生物群落相比具有竞争性的群落被认为不太稳定。正如以前的研究所示,逐渐增加群落内合作相互作用的比例几乎总是会降低总回报率和稳定性的可能性。至于ASD网络中的关键分类群,拟杆菌门产生丙酸和其他短链脂肪酸(SCFA)。用丙酸处理的大鼠模型表现出增加的限制性/重复性行为以及社交行为受损。张J等人发现牙龈拟杆菌诱导小鼠的认知功能障碍,通过神经炎症介导。在我们的研究中,牙龈拟杆菌和本氏拟杆菌显示出最多的相互作用,并被识别为ASD患儿网络中的关键物种。这些细菌与ASD之间的关联需要进一步探讨。此外,与神经系统疾病相关的梭菌属物种之间紧密相连。不利细菌之间的相互作用可能会增强和加速疾病的进展。综上所述,ASD的肠道微生物组观察到不稳定和不利的生态系统。
微生物丰度和相互作用的改变可能影响肠道微生物组的许多功能方面,包括生理化学变化、代谢物交换和信号传导。在我们的研究中,一个有趣的发现是,相对于TD儿童,ASD患儿的几个神经递质合成相关途径显著减少。缺乏色氨酸合成和谷氨酸合成酶可能对宿主的精神反应产生不良影响,并已被认为与抑郁症和其他精神疾病有关。上述数据表明,神经递质相关途径和代谢物可能会损害或不足以支持ASD中的正常生理和精神活动。Ruminococcus属、Lachnospiraceae属和Faecalibacterium属等微生物分类在芳香族氨基酸、L-丝氨酸和甘氨酸合成等功能途径中起着主导作用。尽管这两条途径在ASD患儿中减少,但与TD相比,ASD队列中Ruminococcus属和Lachnospiraceae属的相对丰度并没有显著变化。这些观察结果表明,ASD患儿中L-丝氨酸和甘氨酸合成途径的减少主要是由于Faecalibacterium prausnitzii的丧失,而不是Ruminococcus属和Lachnospiraceae属。
总之,我们的研究首次表明,ASD患儿的肠道微生物组发育异常,并且滞后于同龄人。由于儿童期肠道微生物群的发展代表了人类生长和健康的关键时期,早期生命发育中肠道微生物组的变化可能在ASD的发病机制中发挥重要的功能作用,因此值得进行深入的研究。
本文译自:Wan Y, Zuo T, Xu Z, et al. Underdevelopment of the gut microbiota and bacteria species as non-invasive markers of prediction in children with autism spectrum disorder. Gut, 2022; 71: 910–918.
发表杂志:GUT
影响因子:24.5
通讯作者:Siew C Ng
作者单位:The Chinese University of Hong Kong