
摘 要:
粪便微生物移植(FMT)是一种治疗胃肠道炎症性疾病的治疗手段,但其临床作用机制和随后的微生物群动态仍然不太清楚。在这里,作者分析了316例FMT的宏基因组,分别在干预前后采样,用于10种不同疾病适应症的治疗。作者定量分析了1089种微生物物种的菌株水平动态,辅以47548个新构建的宏基因组组装基因组。供体菌株定植和受体菌株复原力大多独立于临床结局,但使用LASSO正则化回归模型(考虑了宿主、微生物组和操作变量)可准确预测。受体因素和供体-受体互补性,包括整个微生物群落到个体菌株,是菌株群体动态的主要决定因素,为揭示塑造FMT后肠道微生物群的潜在过程提供了见解。将基于生态学的框架应用于作者的发现表明,参数可能为未来开发更有效、更有针对性的微生物组治疗提供信息,并建议在临床实践中如何利用患者分层来增强供体微生物群定植或替代受体微生物。
正文:
粪便微生物移植(FMT)是一种治疗手段,涉及转移肠道微生物、病毒和腔内内容物,以调节受体的微生物群,达到治疗目的。FMT对于各种疾病的有效性已经得到证明,例如复发性艰难梭菌感染(rCDI)或溃疡性结肠炎(UC),它还可以促进微生物群在干扰后的恢复,并可以增强微生物群介导的对其他治疗的反应。然而,尽管在不断增长的临床应用范围内显示出可证明的有效性,FMT的作用机制仍然不太清楚,且目前无法准确地预测临床成功或不良结果。
由于FMT主要针对微生物群,因此“有益”和/或“有害”微生物的植入和排除预期会产生临床效果,与宿主-微生物群相互作用的更具体的过程相结合,例如免疫反应的调节,恢复短链脂肪酸(SCFA)代谢或恢复噬菌体压力。有人认为,微生物群的移植和临床成功主要取决于供体因素,而且理性选择的“超级供体”可能会提高治疗效果。这种以供体为中心的观点后来受到了质疑,至少对于一些指标是如此,突出了受体或程序因素的重要性。
FMT后的微生物组成变化已经在噬菌体或真菌方面进行了研究,但目前的大部分知识都集中在细菌和古菌方面,其中供体微生物的定殖和受体本土微生物的持久性在微生物群体的菌株水平上显现出来。菌株水平的研究表明,FMT后的定殖水平在不同的指标间有所变化:在代谢综合征(MetS)患者中,供体和受体菌株长期共存,而在rCDI中,供体的接管是最常见的结果,而在UC或肥胖中,结果则居中。然而,塑造这些不同的菌株水平结果的因素仍然不太清楚。在小型的试点研究队列中,供体菌株的定殖成功导致短期的持续性,与rCDI中的物种系统发育、广泛的微生物表型和相对粪便丰度相关,但与UC中更具适应性的代谢表型相关。
在这里,作者对FMT前后收集的粪便样本的新颖和已发表的宏基因组进行了荟萃分析,以比较多种疾病指标下供体和受体菌株群体的命运。作者假设,FMT反应的驱动因素最好从生态学的角度来研究: FMT可以被认为是对肠道微生物群的非靶向扰动实验,将供体群落与受体群落相对抗,其结果来自于潜在的生态过程。因此,作者在整个群落的广泛水平和个别物种的特定水平,量化了供体菌株定殖、受体菌株恢复力和FMT后的转换的菌株水平模式。作者建立了交叉验证的模型,根据前期变量(即在干预之前可知的变量)或后期读数(在干预之后测量的变量),来预测FMT结果——在这里定义为供体菌株的定殖和受体驻留菌株的恢复力,进一步按照范围(程序、供体相关或受体相关)和分辨率(宿主、群落和菌株水平)进行分类,产生可测试的假设。将信息性的变量和它们的预测性能与假定的潜在生态过程联系起来,作者提供了一个全面的视角,关于FMT后菌株动态的宿主和微生物群水平的决定因素,与临床背景和更广泛的肠道微生物生态学有关。
结 果:
FMT后菌株动态的荟萃分析,跨越多种疾病。
作者分析了316个时间序列中收集的1492个粪便宏基因组,这些时间序列是为rCDI感染(n=62)、抗超广谱β-内酰胺酶细菌感染(ESBL,n=59)、代谢综合征(MetS,n=50)、溃疡性结肠炎(UC,n=42)、黑色素瘤患者的抗PD1治疗耐药性(n=37)、肠易激综合征(IBS,n=30)、克罗恩病(n=18)、肾癌患者的化疗诱导的腹泻(n=10)、抽动综合征(n=5)和健康志愿者(n=3)进行的。其中,269个样本(来自四个独立的队列)为本研究进行了宏基因组测序(补充表1)。
在作者研究中的283例同种异体FMT病例中,有228例有完整的样本三联体(供体、受体FMT前作为基线和至少一个FMT后的样本);数据集中剩余的33例FMT是受体自己的粪便的自体转移;每个时间序列有3±3个FMT后的样本,最终采样时间点平均在干预后159.4天(补充表1-3和方法)。
作者通过从47548个新建的宏基因组组装基因组(MAGs)和25037个高质量的参考基因组(图1a和方法)构建的全基因组(一个微生物物种的所有已鉴定的基因的总和),分析了1089种微生物物种,其中包括144种以前未描述的物种。作者比较了受体的FMT前微生物群与他们各自的供体,以识别单核苷酸变异(决定性SNVs,如前所述25)和基因内容的差异,并使用这些(宏)基因组标记来评估供体和受体菌株在FMT后样本中的命运(图1b,c)。对于每个物种,作者将结果分类为:供体定殖(即,FMT后的菌株群体由供体菌株占主导);受体持续性(由受体菌株占主导);同种供体和受体菌株的共存;“新颖”菌株的流入(未在基线样本中检测到的菌株,代表低丰度菌株的扩张或FMT后新菌株的引入);供体排斥(未能以可检测的浓度移植);和所有受体菌株的丧失(图1c,d,方法和补充表5)。
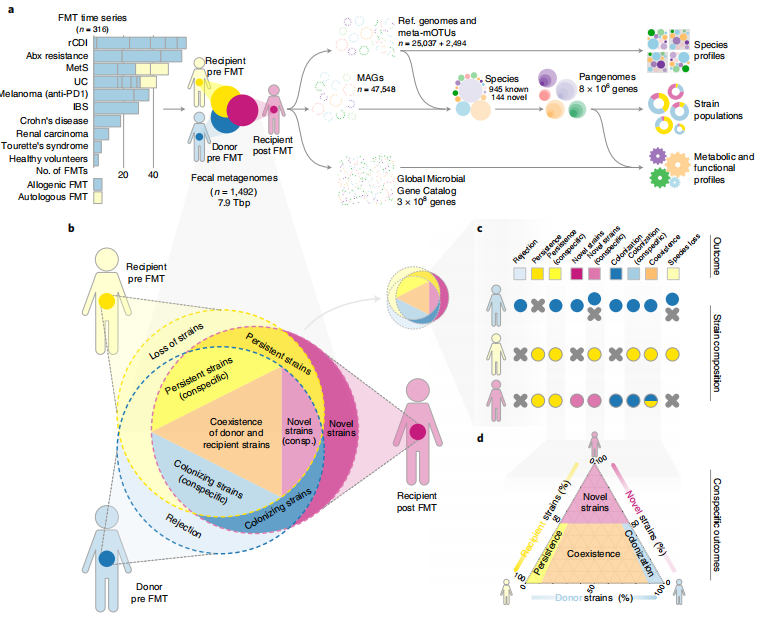
图1 | 研究设计和工作流程概述。
a,作者分析了316个FMT时间序列的数据集,涵盖了十种疾病指标和22个队列,共计1492个粪便宏基因组。物种全基因组是从参考基因组和新生成的MAGs构建的,并根据微生物SNVs和差异基因内容,对样本进行了分类、功能和菌株群体组成的分析。b,每个同种异体FMT被表示为一个由供体FMT前(蓝色调)、受体FMT前(黄色)和FMT后(紫色)样本组成的三联体;每个样本的菌株群体用重叠的圆圈表示。c,使用决定性SNVs和基因内容的模式(补充表5),对每个物种的FMT菌株水平结果进行了评分。d,菌株群体空间的三元图,表示同种受体菌株的持续性、供体菌株的定殖、供体-受体的共存和新颖菌株的流入。
供体菌株的定殖独立于临床结果
总结所有追踪物种,供体和受体菌株的定植和持久性在同种异体FMT患者中差异很大(图 2a,b)。在分析的任何一例 FMT 中,作者都没有观察到完全的受体菌株转换(所有菌株的丢失)或完全的供体排斥(定殖失败),尽管在一些患者中,受体菌株的持续性或供体菌株的定殖率非常低。结果根据 FMT 前物种的存在情况而有所不同:供体菌株的接管(占 FMT 后物种的 18.0±16.0%)和受体菌株的持续性(11.3±9.1%)更频繁地发生在供体或受体中存在的物种中,但不是两者都存在的物种中。相反,在供体和受体在 FMT 前都存在的物种中,供体和受体菌株的共存(19.0±11.8%)是最常见的结果,与供体定殖(4.5±4.0%)和受体持续性(5.6±5.2%)相比。在 FMT 后的菌株群体中,41.5±21.0% 的菌株归因于新的菌株或完全新的物种,这些物种在 FMT 前的供体或受体中不存在(或之前低于检测限)。这种向新菌株的主要转换可能与干预本身有关,因为在自体 FMT 中,新的或以前未检测到的菌株占 50±10.1%。
供体和新颖菌株的接管是rCDI或UC患者的特征,而MetS FMTs则主要导致同种菌株的共存,其他测试指标的结果则各不相同。临床反应与任何指标的菌株水平动态无关;换句话说,患者缓解与供体菌株的定殖或受体菌株的排除没有显著的联系,无论是对于个别物种还是跟踪的所有物种(补充图1)。特别是,作者的数据不支持早期的假设:即SCFA产生的恢复是UC和rCDI缓解的标志,因为FMT后肠道代谢模块(GMM;乙酰乙酸生成、丙酸生成和丁酸生成的方法)的增加与临床结果无关。
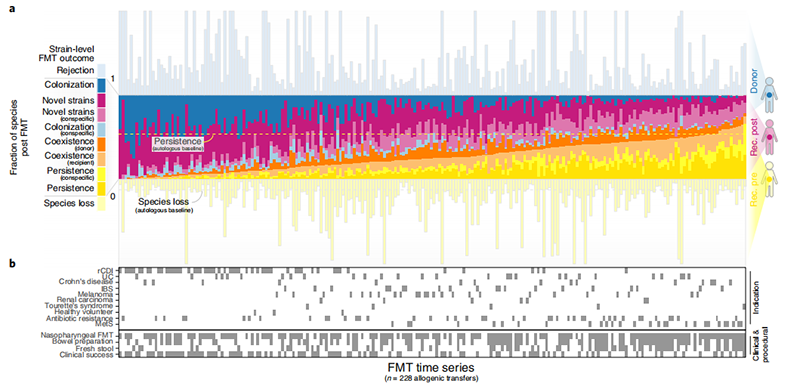
图2 | 群体范围的FMT结果在患者和指标间有所不同。
a,228个可评分的同种异体FMT时间序列的微生物群水平结果,概括了在供体和受体(rec.)中观察到的所有菌株群体。分数是根据FMT后受体中观察到的物种数量进行归一化的。b,每个FMT时间序列的指标、程序和临床结果的背景数据
受体因素而不是供体因素驱动FMT后的菌株动态。
为了识别与定殖结果相关的因素,作者使用交叉验证的LASSO正则化线性回归(方法)训练了一系列预测性的机器学习模型。在可能的预测因子中,作者根据FMT干预前可知的前期变量(图3a)和FMT后可测量的后期变量(图3b)进行了区分。此外,作者还根据变量的范围(程序、供体相关和受体相关)和分辨率(宿主、群落和物种水平)对预测因子进行了分类,总计超过400个变量作为正则化输入(补充表6)。然后,作者为各个预测因子类别(例如,仅使用程序变量)建立了交叉验证的模型,以及组合模型,以评估结果的整体可预测性。
利用前变量的正则化组合,可以以中等精度预测出供体和受体菌株共存和受体菌株持续存在的物种比例(LASSO R2分别=0.58和0.49),供体定殖(R2=0.34)和受体菌株恢复力(R2=0.35)的变化较小;图3 a)。有趣的是,供体菌株成功接管的比例并没有很好地预测(R2=0.1309)。
为了确定菌株结果的主要决定因素,作者比较了使用受限变量子集的模型和使用所有变量的完整模型的准确度。限制在群落多样性指数(包括物种丰富度)或FMT前受体中的物种丰度的模型达到了相似的准确度,反映了这两个因素在预测FMT后供体和受体菌株的命运方面的重要性。此外,在所有模型中,捕捉受体因素或供体-受体微生物组互补性(例如,群落差异性)的变量比供体因素更具预测性。影响菌株水平结果的最重要的预测因子包括FMT前受体的物种丰富度和选定物种的丰度,特别是Bacteroides uniformis、Bacteroides vulgatus和一种Oscillibacter物种,它们与总体受体菌株的持续存在和共存呈正相关。相反,基于程序、代谢或供体物种变量的模型准确度较低(图3a,左)。值得注意的是,与先前的发现相反,供体携带与SCFA合成相关的GMMs与菌株定殖的增加没有关联。然而,在FMT前受体中携带丁酸合成基因的高度与总体菌株持续性呈中等相关,即具有较高丁酸合成潜力的受体群落通常更具恢复力,进一步突出了受体微生物组在FMT后菌株动态中的作用。
在本研究中使用的人群中,rCDI状态与FMT后微生物组中成功定殖供体菌株的比例更高相关。然而,作者注意到,虽然作者数据集中的>90%的rCDI患者在干预前接受了抗生素治疗,但大多数其他指征的患者没有(或经历了延长的清洗期),因此rCDI和抗生素的效果无法分离。此外,在从所有变量中选择的完整模型中,受体的物种丰富度和个体物种丰度是受体菌株持续存在的更稳健的预测因子,而不是rCDI状态。这表明,在rCDI患者中观察到的供体菌株定殖的高水平可能部分是由于一个更不稳定的微生物群落(可能是由抗生素使用引起或加剧的),而不是一种特定于疾病的效应。
在事后变量上训练的模型被发现具有很高的准确度,特别是在描述供体定殖时(图3b)。 如预期的那样,受体中整个群落的组成变化的强度(Bray–Curtis差异性和FMT前后的代谢差异性)与受体菌株的持久性较低有关。 有趣的是,FMT后没有单个物种的丰度与定殖结果强烈相关。 然而,特定物种的成功定殖(图3b,右)对供体菌株的总体定殖具有很高的预测性,特别是B. uniformis、B. vulgatus、几种Oscillospiraceae sp.和Lachnospiraceae sp.,包括Anaerostipes hadrus。这些可能被认为是指示物种,它们的成功嫁接与供体菌株的总体更高的流入相关。
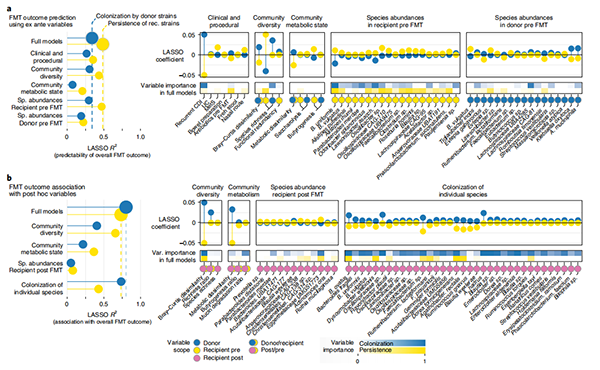
图3 | FMT群体水平结果的驱动因素和决定因素。
a,使用交叉验证的LASSO线性模型,根据不同变量类别的正则化子集或所有变量(“完整”模型)的组合,在干预前可知的情况下,预测个体FMT的微生物群体广泛结果(在供体、FMT前受体和FMT后受体样本的三元组中汇总所有可追踪的菌株群体;图2)(方法和补充表6)。在每个类别中,只包括最相关的预测因子。每个结果指数的预测性能显示为左侧的R2,最具预测性因子的变量重要性和方向性显示为右侧的交叉验证LASSO系数。b,FMT结果与LASSO正则化的事后变量集合(在干预后测量)的关联。
FMT后菌株结果是物种特异性和可预测的
上述分析描述了所有追踪物种的总结结果,作者接下来研究了每个物种在FMT后的菌株群体动态。为了获得足够的统计功效,作者关注了在作者的研究数据集中在>50个同种异体FMT中检测到的307个物种(图4和补充图1和2)。所有物种都观察到了受体持续性、供体定殖、共存和新菌株的流入,没有明显的系统发育信号。作者没有观察到任何物种在所有FMT中表现出一致的定殖(“超级定殖者”)或持续性(“超级持续者”)的模式。然而,作者观察到了两种广泛不同的FMT后菌株动态类型,在同种FMT三元组中(即,在干预前同时存在于供体和受体中的物种;图4a和补充图2)。大多数物种表现出了一种强烈的倾向,即供体-受体菌株的共存,这与初始菌株丰度无关。值得注意的是,这些包括了常见的共生菌,如Bacteroides sp.、Blautia sp.、Dorea sp.、Ruminoccocus sp.和Faecalibacterium sp.相反,对于Veillonella parvula、几种Streptococcus spp.、Eggerthella lenta、Akkermansia muciniphila和Prevotella copri,菌株群体强烈倾向于供体、受体或新菌株的优势,共存很少,这表明这些物种在同一宿主内可能天生不太容易携带同种菌株。
菌株水平的FMT结果在每个主要的分类群中都有所不同,而且在不同的分支之间没有相关的差异(图4b,c)。选择性需氧物种的菌株定殖成功率较低(方差分析(ANOVA),R2=0.02,P=0.002),而携带丁酸合成(R2=0.026,P=2×10−4)或丙酸合成(R2=0.008,P=0.05)途径基因或一般的糖分解(R2=0.046,P=1.1×10−6)或蛋白分解(R2=0.047,P=8.5×10−7)代谢设置的菌株与较高的定殖成功率相关。
为了解开每个物种的FMT后菌株结果的贡献因素,作者使用与上述讨论类似的事前和事后变量集合,构建了物种特异的交叉验证的逻辑LASSO回归模型(图4d)。 对于每个物种,作者对菌株水平的结果进行了分类,将受体的恢复力定义为受体菌株持续存在的事件(作为优势群体或与供体菌株共存;黄色),供体的定殖(供体菌株成功定殖为优势或共存群体;浅蓝色),供体的接管(供体菌株成为优势;深蓝色)和受体的转换(由供体菌株和/或新的或先前不可检测的菌株占据优势;紫色)。当使用所有可用的事前变量训练模型时,受体的恢复力(LASSO曲线下面积(AUC)=0.62±0.13)、供体的定殖(0.58±0.10)和供体的接管(0.65±0.14)具有中等的预测准确度,而且在不同的分类群之间和之内存在一些变化(图4d)。 相反,受体菌株的转换(AUC=0.94±0.05)在几乎所有物种中都具有很高的预测准确度,表明受体中居民菌株群体的置换(不仅仅是由供体菌株接管,而是由任何方式)可能通常是一个更确定性的过程。

图4 | 菌株水平的FMT结果因物种而异,但事前可预测。
a,选定物种的菌株水平结果显示为同种FMT三元组,即焦点物种在FMT前同时存在于供体和受体中的时间序列。结果按照受体菌株持续性(受体菌株占优势,黄色)、供体接管(蓝色)、供体-受体共存(橙色)或新的或先前未检测到的菌株的流入(紫色)进行评分,如左侧的示意图所示。每个点对应一个评分的FMT。b,堆叠条表示每个物种在可评分的FMT中的结果,按照在干预后受体中观察到的FMT的数量进行缩放。虚线表示分类群内(x轴)受体菌株持续性的平均值。所有物种的结果频率在左侧进行了总结。c,每个物种的供体或新的(先前未检测到的)菌株的定殖频率,作为b中数据的子集。每个分类群的平均值用虚线表示。d,LASSO模型对不同的二值化FMT结果(左侧指示;方法)的预测准确度,以AUROC表示,按每个物种的交叉验证折叠进行平均。
受体微生物组驱动物种特异性的菌株动态。
作者构建了LASSO模型,它们被限制在不同的预测变量子类别中,并将它们的性能与在整个事前或事后变量补充(图5a)上训练的完整模型进行了比较。仅在受体FMT前物种丰度、焦点物种的丰度和菌株群体特征以及在较小程度上在微生物组群落多样性变量上训练的模型达到了最高的准确度,与完整模型相当。值得注意的是,单个受体物种的预测能力几乎完全归因于排斥效应,意味着受体中某些物种的富集与其他物种的供体接管或受体菌株转换的减少相关,而促进效应没有贡献作用。限制在程序因素(包括疾病指征)、FMT前代谢状态或供体物种丰度的模型比完整模型的准确度低得多,表明这些变量组对菌株水平结果的预测性较低。总体而言,作者观察到在事后变量上训练的模型的类似趋势(图5a,右)。
对于大多数物种,作者发现菌株转换可以使用两个群落水平的微生物组多样性指标准确地预测,即FMT前受体的物种丰富度和供体-受体群落差异性,这是限制在群落多样性变量的模型中选择的主要因素(图5b)。低丰富度和受体微生物组相对于健康供体的强烈组成转变是与疾病相关的微生物组状态的特征,作者的数据表明,这种弥散的不平衡的强度,与疾病(如作者数据集中的rCDI或UC)或其他干扰(例如,抗生素预处理或肠道清洗)相关,直接与大多数物种的FMT结果相关。相反,供体的丰富度或功能冗余,先前被认为是相关的49,只是次要的预测因子,如果有的话。代谢变量同样是不可靠的预测因子。群落范围的丁酸合成潜力与受体中的转换呈负相关(即,携带高负荷的丁酸产生基因的受体中的菌株群体更具恢复力),但供体中的丁酸合成水平并没有相应地促进定殖。然而,在受体菌株转换的完整模型中,这些变量被受体微生物组中的指示物种(见下文)和焦点物种特征(特别是受体菌株群体多样性;图5b)所取代。
供体菌株接管的最强预测因子是物种的供体/受体丰度比(如先前对rCDI27的建议),表明进入的可行供体微生物的数量(也称为传播压力)可能提供了供体菌株定殖成功的中性基线估计,特别是对于在FMT前受体中不存在的物种(图5b,c)。 一般而言,虽然供体/受体比是最具预测性的,但潜在的信号是由受体微生物组中的物种丰度(或缺失)驱动的,而不是供体微生物组中的。种内菌株群体特性——供体/受体菌株群体差异性和受体(以及在较小程度上,供体)菌株群体多样性——也具有很高的预测性,但效果更微妙:供体菌株接管在供体和受体之间具有互补菌株群体的物种中更有可能发生,而多样的受体群体(不被个体菌株占据优势)比不均匀的群体更具恢复力。此外,与受体群落系统发育上互补的进入物种(即,增加新颖性——例如,通过填补一个未占据的生态位)更有可能定殖或转换居民群体。
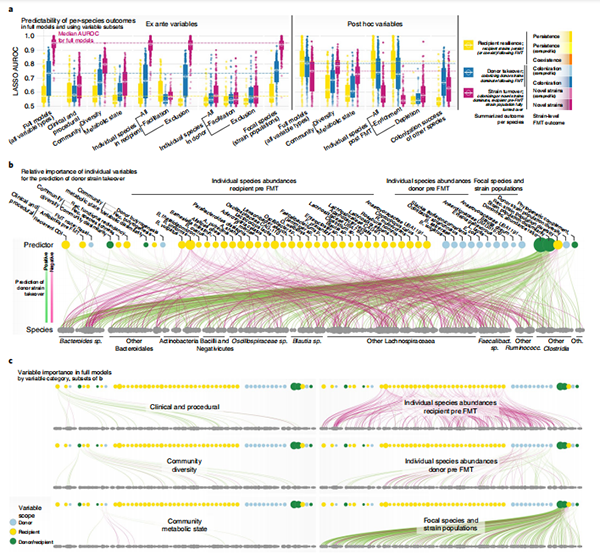
图5 | 个体物种的FMT菌株水平结果的驱动因素和决定因素。
a,使用不同的事前变量子集(在干预前可知的)对n= 307个物种在FMT时间序列中的FMT二值化结果(受体恢复力,黄色;受体转换,紫色;供体接管,蓝色)进行预测的逻辑LASSO模型。每个点代表一个物种的数据。数据显示为完整模型(从所有可用变量中选择)和在按类型(程序、群落水平多样性等)分类的变量子集上训练的模型。物种模型的预测性能以边缘箱线图中LASSO交叉验证折叠的平均AUROC显示,范围从0.5到1.0;中心线,中位数;箱体限制,上下四分位数;须,上/下四分位数之外1.5× 四分位距内的最大值/最小值。b,预测供体菌株接管的完整模型中的变量重要性。每条边表示一个预测变量(顶行)在预测给定物种(底行)的供体接管时的重要性。预测变量的点大小表示所有物种的变量重要性之和;物种(底部)的点大小表示相关预测变量的总数。边的颜色和宽度分别表示关联的方向和强度。c,单个预测变量类别的变量重要性,作为b中数据的子集。
受体“看门人”物种抑制供体菌株的嫁接
考虑到FMT涉及将受体的残留微生物群体与来自供体的入侵微生物群体相对抗,作者特别探讨了个体物种对其他物种嫁接的影响,通过训练限制在供体或受体FMT前物种丰度(图5a)的模型,并探索个体物种在完整模型中作为预测因子的相关性(图5b,c)。作者提取了嫁接抑制和促进的网络,将供体和受体中假定的效应物种的丰度与焦点物种中的供体接管事件相关联。绝大多数的相互作用是抑制性的(图5a-c):对于大多数物种,供体和受体中的高丰度与其他物种的嫁接呈负相关。这些排斥效应对于受体的居民群落(AUC=0.63±0.14)比供体(AUC=0.53±0.06)更强。
定殖抑制在系统发育上是集中的,即,在同一分支内的相关物种之间的抑制性相互作用比在不同分支之间的更常见(图5B)。受体微生物组中的Bacteroidales,特别是B. uniformis、B. vulgatus、Alistipes shahii和Parabacteroides distasonis,是最强的定殖抑制剂,但也包括了两个最强抑制的物种,Bacteroides xylanisolvens和Bacteroides ovatus。换句话说,受体微生物组中诸如Bacteroidales这样的看门人物种的富集抑制了一大批物种的定殖,反之亦然,这与先前的发现一致,即Bacteroidales的亚群在健康个体中也通常具有很高的持续性。受体中的Lactococcus lactis、Streptococcus salivarius和Dialister invisus是最主要的定殖促进剂。与定殖抑制相反,促进通常影响系统发育上遥远的物种,例如,受体Pauljensenia sp.(一种放线菌)对Paraprevotella clara和Erysipelatoclostridium ramosum的定殖的促进是在所有物种中观察到的最强的相互作用之一。
作者观察到供体微生物组中很少有突出的预测性物种,最值得注意的是B. vulgatus和Evtepia gabavorous。供体物种的促进和抑制效应通常是有限的,而且总体上对定殖成功的预测性较低,表明供体微生物组对定殖结果的影响除了种内菌株动态之外是有限的。
适应性和中性过程塑造了FMT后的微生物群。
通过肠道生态学的视角来理解,FMT后菌株水平结果的准确预测不仅具有描述性的关联,而且具有信息性:FMT是群落水平的扰动实验,可以在入侵生态学和群落组装的框架下进行解释,以识别塑造微生物群的过程和机制。因此,作者将作者模型中测试的各种变量与假定的潜在机制(图6)联系起来,沿着从中性/随机因素(例如,供体传播压力:进入的可行供体微生物的数量)到适应性/选择性因素(例如,生态位效应)的梯度进行分类。作者进一步区分了受体特异性、供体特异性和供体-受体互补性效应,并按照粒度将变量组织起来,从宿主水平因素(例如,临床或程序)到微生物群群落水平(总体组成和可能的物种相互作用)和物种内(菌株水平)效应。
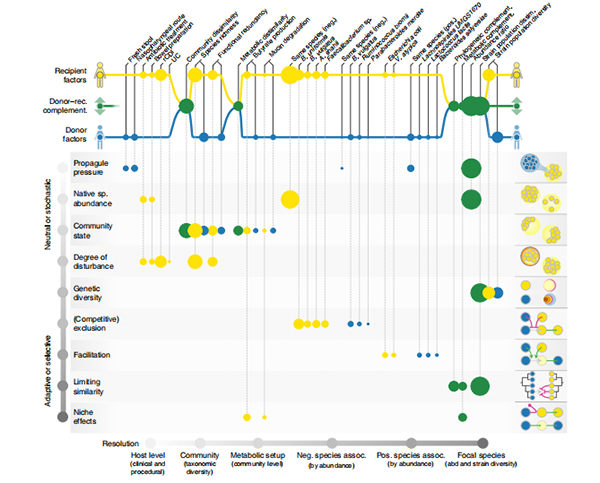
图6 | FMT菌株水平的结果受中性和适应性过程的共同影响。
用于预测FMT结果的每个测试变量都可以与假定的潜在生态过程联系起来,正如以前所建议的。因素按照范围(与供体、受体或供体-受体互补性相关,顶部)和分辨率(宿主、群落、物种和菌株水平;从左到右)进行组织。潜在的生态过程可以沿着梯度大致排列,从中性/随机到适应性/选择性;每个过程在右边用一个玩具例子进行说明。圆圈大小对应于平均变量重要性,从LASSO系数和整体模型性能(预测能力较低的模型惩罚变量重要性)计算出所有测试物种。受体因素,特别是在所有分辨率上的供体-受体互补性措施,通常比供体因素更相关于物种水平的结果。neg,负;pos.,正;abd,丰度。
与供体读数相比,与受体或供体-受体互补性相关的因素对FMT定殖结果的影响更大,这在所有测试的变量和不同的物种中都是一致的。换句话说,正如上面所概述的,供体微生物群并没有特别影响定殖或转换本身,而只是在与受体微生物群的互补性方面有所作用。供体/受体丰度比例是FMT结果的重要决定因素,可以解释为进入的供体细胞的传播压力和残留受体群体的本地丰度之间的平衡,提供了一个关于中性机制如何塑造FMT后群落的基线。在这方面,受体中驻留菌株的排斥效应是占优势的,也就是说,受体微生物群的耗竭对于成功定殖的相关性比供体菌株的更高剂量更大。在实践中,这种相互作用可能在一定程度上受到程序的调节,例如,通过使用新鲜或冷冻的粪便(影响供体细胞的生存能力),FMT途径(直肠或十二指肠)或通过肠道准备或抗生素预处理来清除受体群落,尽管这些程序变量本身并不是作者分析中的稳健预测因子,可能是因为它们与数据集中包含的个体研究混淆了。
受体(而不是他们各自的供体)的微生物群组成也与FMT菌株水平的结果相关:广泛的群落耗竭(低丰富度)和与健康供体的明显组成差异可能表明一般受干扰和不稳定的微生物群,对供体菌株的接管更不抵抗。相反,门控物种(例如B. uniformis或B. vulgatus)的残留富集也与供体菌株的定殖呈负相关,可能表明竞争性排斥过程和种间优先效应。虽然根据设计,不能从作者的数据中推断出因果关系,但这些结果与现有的关于微生物群稳定性和恢复力的生态理论相一致,例如,关于临界元素和临界转变,导致肠型的群落多稳定性,优先或“安娜·卡列尼娜”效应。作者发现了有限的证据支持跨物种界限的定殖促进,无论是在供体还是受体中。同样,作者的数据也不支持群落范围的代谢状态有强烈的作用:无论是一般的代谢设置还是特定的代谢模块,如供体或受体中的SCFA产生,都对FMT结果没有很大的影响。
供体菌株定殖的最强效应出现在物种和菌株水平上。进入的物种如果在系统发育或代谢上与残留群落互补,更有可能定殖,这意味着它们能够占据未被占据的生态位。定殖成功与特定于局部群落的互补性相关。供体中的同种多样性高和受体中的多样性低也与移植成功相关:由单一菌株占主导的受体群体更不具有恢复力,而来自更多样化的板块的供体菌株更有可能定殖,这可能是由于菌株水平的限制性相似性效应。的确,如果供体的同种菌株群体与受体菌株不相似,它们的定殖成功率更高,表明存在强烈的抑制性的物种内优先效应。
然而,作者再次注意到,个别物种的定殖是以中等的准确度可预测的,而不受所使用的变量集的影响,这与残留菌株群体的转换不同,后者是高度可预测的。这意味着定殖成功在很大程度上可能是随机的。
讨 论
粪便微生物移植是一种临床操作,也可以被认为是一种复杂的自然扰动实验,将供体的肠道微生物群落与受体的相对抗。如果FMT能够触发患者的缓解或恢复,那么它就被认为是临床上成功的,而从生态学的角度来看,成功的程度是供体的微生物群能够在受体中定殖的程度。鉴于FMT的目标是肠道微生物群,所以预期移植和临床成功是相关的,这意味着成功的微生物群调节介导了临床效果。然而,这一假设以前没有被系统地测试,而且确实不受作者的数据支持。作者的数据并没有排除更微妙的联系,特别是考虑到作者每个指标的样本量有限,以及不同研究之间的FMT方案的差异,但是供体微生物群定殖在塑造临床反应中的明确作用并没有显现出来。作者确实观察到,在患有rCDI或UC的患者中,供体菌株定殖的总体水平较高,与作者数据集中其他疾病相比,这些疾病的临床反应率也较高。然而,这可能是由于这些疾病相关的整体微生物群状态更加扰乱(可能是由于抗生素治疗方案引起的),超过了疾病特异性的影响:作者发现,在临床应答者和非应答者之间,菌株水平的结果没有显著差异。
了解微生物组水平的FMT结果既具有临床相关性(例如,用于知情的供体选择或避免可能的不良影响),也更普遍地为塑造肠道微生物组的生态过程提供信息。所有研究物种均表现出所有FMT结果,具体取决于环境;作者没有发现有力的证据表明任何物种本质上比其他物种更具侵袭性或恢复力。相反,决定恢复力、共存和定殖的是物种内菌株群体的细尺度结构和多样性,以及供体-受体菌株群体的互补性,尽管作者注意到,虽然大多数物种倾向于同种供体-受体菌株的共存,但有一小部分物种通常倾向于受体或供体菌株或基线时不可检测的菌株的优势。物种之间的相互作用不太相关,但结构清晰:受体中的几种门控物种,特别是拟杆菌属的物种,抑制了其他系统发育上不相关的物种的定殖,而跨物种界限的定殖促进则很少见。
作者发现,使用一致的和令人惊讶的小的前期微生物群变量选择,几乎所有研究的物种的受体菌株的转换都可以非常准确地预测。相反,作者的模型在预测供体菌株的定殖时,只能达到中等的预测准确度,表明定殖在很大程度上是随机的或受到作者研究范围之外的其他因素的影响,例如病毒或真核微生物群成员,受体免疫状态,药物或干预后厌氧供体粪便细胞的生存能力降低。
受体因素在驱动FMT菌株水平结果方面始终超过供体因素。因此,作者的数据不支持超级供体假说,该假说认为某些供体微生物群特性对于定殖和临床成功(通过代理)是至关重要的。相反,作者发现,供体和受体微生物群的互补性促进了供体的定殖和受体的转换。这种现象在微生物分辨率上都有观察到,从群落水平的效应到同种菌株群体的差异性。的确,菌株水平的多样性和互补性是FMT结果的最强决定因素,与临床实践中的合理供体选择有关。除了对供体健康进行筛查外,还可以根据微生物群在群落、物种和特别是菌株水平上的互补性来匹配供体和受体,这可能增加定殖成功率,使临床结果更可预测,并减少不良影响。
作者的数据表明,FMT 后肠道菌群的形成受到中性和适应性过程的共同影响,与以前的报告相一致。作者发现,肠道菌群在群落、物种和菌株水平上的恢复力的极限可以由一组相对较小的可测量变量来定义,这些变量指向不同的潜在过程。传播压力和残留物种丰度之间的(互补)相互作用提供了定殖的中性基线,尽管如此,受体效应仍然超过了供体效应。与此同时,作者的数据也暗示了生态位效应,特别是在互补的种内菌株群体水平,尽管在分析中没有出现一致的适应性特征。先前关于代谢能力(如 SCFA 合成)的重要性的假设没有得到支持,尽管作者注意到,从宏基因组数据推断 SCFA 生物合成途径仍然具有挑战性,而且没有捕捉到 SCFA 合成基因的可能的差异表达。
按照设计,作者的研究主要是描述性的,只探索了作者的观察结果背后的潜在机制,以便在生态学的背景下进行解释。此外,作者的研究重点关注细菌和古菌微生物群(不考虑病毒和真核生物),并受到作者数据集中一些疾病指标的相对较小的可用样本量,队列之间的技术、程序和生理异质性,以及宏基因组菌株检测的固有限制的影响。尽管存在这些变异来源,作者的核心发现仍然是稳健的,因此可以从多个方面指导微生物移植(FMT)的临床应用,特别是当微生物群调节是超越缓解或缓解症状的期望目标时。干预之前,可以根据一些粗略的、稳健的、容易获得的微生物群读数来对患者进行分层,例如群落丰富度和高层次组成,或者根据与整体微生物群恢复力相关的门控物种的存在情况。相比之下,供体选择的相关性主要受限于供体(菌株水平)与受体的互补性程度。程序参数的调整(抗生素预处理、粪便制备、剂量、FMT途径、供体的饮食摄入等)可能主要影响受体微生物群的恢复力,而一个总体上更有恢复力的反应(当然,排除要被置换的靶病原体)通常是可取的。在物种界限上的定殖抑制和促进都出奇地稀少和温和,只有少数例外,这表明针对个别物种的定殖或转换主要可以独立于残留和共转移的群落实现,最大限度地减少对受体微生物群的副作用。
作者的结果表明,FMT后的微生物组动态受到可在临床实践中调节的确定参数的影响,从而支持了使用个性化益生菌混合物而不是整个复杂粪便样本进行可预测和有效的微生物组调节的概念,这是可能的,并且可能从生态学的角度受益。特别是,作者的发现表明,在受体中有针对性地消耗选定的微生物,并同时引入同一物种的多样菌株群体而不是单一菌株,是一种增强受体中定殖和转换的有前途的方法,尽管与临床结果的联系仍有待建立。因此,利用中性和相关的适应性生态过程,可能为针对肠道微生物组的个性化调节干预铺平了道路,这些干预具有可预测的微生物组水平结果。
本文译自: Thomas S B Schmidt, Simone S Li, Oleksandr M Maistrenko, et al. Drivers and determinants of strain dynamics following fecal microbiota transplantation. Nat Med
. 2022 Sep;28(9):1902-1912.
发表杂志:Nat Med
影响因子:88
通讯作者:Peer Bork
作者单位: European Molecular Biology Laboratory, Germany.