
血液代谢组的变化与人类健康密切相关。然而,关于遗传和微生物组在解释这种变化的代谢物水平上的相互作用,我们知之甚少。在这里,我们对930种在1569个个体的队列中稳定检测到的血液代谢物进行方差分析,这些个体具有配对的基因组和微生物组数据,同时控制了一些相关的协变量。我们发现,595种(64%)血液代谢物显著地与宿主遗传或肠道微生物组相关,其中69%的相关性仅由微生物组驱动,15%的相关性仅由遗传驱动,16%的相关性由基因组-微生物组混合控制。此外,交互效应,即代谢物-微生物关联特定于某一遗传背景,也相当常见,尽管效应大小较小。这些知识将有助于指导针对性的干预措施,以改变人类血液代谢组的组成。
引言
人类血液代谢组是由内在和外在的力量共同塑造的,它构成了人类代谢的主要资源库。虽然血浆代谢物库的组成受到饮食、生活方式和肠道微生物群落的强烈影响,但血液中个别代谢物的命运通常受到宿主遗传的严格调控。
已知遗传变异会在一些与疾病相关的情境中改变人类血液代谢组。例如,某些有害的等位基因影响胆固醇水平,导致高胆固醇血症,而另一些众所周知的等位基因促进苯丙氨酸的积累,导致苯丙酮尿症。与血液代谢物水平相关的遗传变异中,大多数影响酶或溶质载体,从而直接影响个体产生、消耗、分泌或吸收小分子的能力。目前已经发现的许多与代谢组相关的遗传变异是多效性的,这表明代谢组在身体不同系统之间具有广泛的相互联系。
最近的研究发现,人类肠道微生物组是血液代谢物变异性的一个主要决定因素。在一项先前的工作中,发现宿主遗传和肠道微生物组组成与血浆代谢物水平呈现出大致正交的相关性,这一观察结果得到了支持,即在大多数情况下,宿主遗传和肠道微生物并不倾向于强烈地相互关联,尽管已经显示出一些明确的基因组-微生物组关联的例子。
尽管这些广泛的多元回归结果显示了基因组学、微生物组和代谢组之间的全面对应关系,但人们对这如何映射到个体血液代谢物水平知之甚少。虽然人们可能会认为,细菌在人类肠道中产生的代谢产物的变化主要由微生物群决定,并且人类代谢过程特有的代谢产物更多地与宿主遗传学有关,但也有一些例子,比如微生物-宿主的共代谢产物,如共轭胆汁酸,情况变得更加复杂。
肠道信号,如人类肠道中FXR和TGR5受体的激活,可以调节葡萄糖、胰岛素、胆固醇和胆汁酸的稳态。此外,许多由微生物组衍生的代谢物被肝脏酶修饰并转化为一系列结合化合物,如马尿酸或多胺。这些关于微生物-宿主共代谢的多层过滤器使得将血液代谢物映射到潜在的微生物前体具有挑战性。例如,血液胆固醇水平受到宿主基因变异的影响,但它们也可以通过肠道信号调节,包括肠道共生体产生次级胆汁酸,或通过肠道微生物胆固醇脱氢酶将宿主和饮食胆固醇输送到粪便粪甾醇中。因此,尽管宿主遗传学和微生物组似乎对整个血液代谢组有很大的正交影响,但它们仍然作用于一组重叠的代谢产物,有可能解释这些化合物变异的独立成分。
此外,即使在缺乏人类肠道共生微生物的强大遗传力的情况下,也有一些关键的例子表明,遗传和微生物组可能在特定的疾病条件下相互作用,如囊性纤维化。这就提出了一个问题,即是否存在微生物组-代谢组关联由宿主的遗传背景以类似于其他基因-环境相互作用的方式调节,在这种相互作用中,特别是当暴露于特定的环境风险因素时。
在这里,我们研究了来自美国的健康个体1569人队列中血浆代谢物丰度的变异性 。我们发现血液中个体代谢物水平的遗传和肠道微生物决定因素之间存在广泛的相互作用,这为控制人类血液代谢组组成的微生物-宿主共代谢提供了深入的见解。
结果
与遗传学和微生物组相关的代谢产物
我们对1569名健康队列进行了基因组-代谢物和微生物组-代谢物关联测试 个体,在30天内每一天采集成对的血液和粪便样本 。该队列由美国的个人组成,大部分来自西太平洋地区。这些人总体健康,年龄在18岁至87岁之间 岁,主要为女性(63.5%),平均 体重指数(BMI)为28.2 ± 6.6。数据集中的代谢物丰度首先根据常见的混杂因素进行调整,然后将残差用于进一步的下游分析(927个代谢物与至少一个混杂变量相关,假阳性发现率(FDR)校正P < 0.05,平均R² = 0.12 ± 0.06)。该队列被随机分为1,000个个体的训练队列和569个个体的验证队列。在训练队列中进行了微生物组-代谢物和基因组-代谢物的关联分析,然后将训练队列中得到的系数固定在验证队列的模型中,以生成样本外的R²估计(图1a)。
为了确定宿主遗传学和个体循环血液代谢物水平之间的关联,我们对来自训练队列的1,000个个体中的7.68百万个常见变异(次等位基因频率≥1%)进行了全基因组关联分析,针对每个通过我们流行度阈值的930个血液代谢物。在测试的930个代谢物中,有182个(19.6%)与通过全基因组显著性阈值(P < 5.37 × 10−11;扩展数据图1)的297个独立引线变异中的一个或多个相关。在这297个变异中,79个位于基因间区域,218个映射到123个基因,其中包括与遗传代谢紊乱相关的基因,如ACADS、ALMS1和GCKR。对于两个变异,预测了潜在的功能丧失后果:在HYKK中获得了一个终止符号的rs183603441和在KMO中的一个剪切供体变异rs61825638。对于25个变异,预测了错义突变,影响了39个代谢物。然而,在基因内发现的大多数与代谢物相关的变异都是同义的。
特别是,乳糖基神经酰胺乳糖基-N-神经酰基鞘氨醇(d18:1/24:1)与位于ABCA7的主效变异rs3752246(P = 9.8 × 10−14)和rs3752248(P = 5.6 × 10−13)相关。rs3752246是一种错义变异,已被先前确定为晚发型阿尔茨海默病的风险变异。以前的研究已经发现阿尔茨海默病患者的血液和大脑中神经酰胺水平发生了改变,其中d18:1/24:1神经酰胺在最近的一项荟萃分析中显示出与该病状强烈而稳健的相关性。我们的结果进一步强调了乳糖基-N-神经酰基鞘氨醇(d18:1/24:1)水平和晚发型阿尔茨海默病之间可能存在的共享遗传结构。
在297个显著的主效变异中,有70个(23.6%)与多种代谢物相关,揭示了我们队列中多效性的程度。多效性变异的效应大小通常高于非多效性变异(中位效应大小差异0.08,P = 0.04,双侧曼-惠特尼U检验),而次等位基因频率的分布在两种类型的变异之间相似。总的来说,70个多效性主效变异与92种代谢物相关(所有显著遗传相关代谢物的52.2%)。四个变异(rs4149056、rs1047891、rs148982377和rs45446698),其中rs4149056和rs1047891是错义变异,每个与超过八种代谢物相关。SLCO1B1中的rs4149056(肝脏中的溶质转运体)与八种代谢物相关,包括初级和次级胆汁酸、多不饱和脂肪酸和游离脂肪酸的结合物。CPS1中的rs1047891(参与尿素循环的线粒体酶)发现与八种代谢物相关,其中许多与甘氨酸和谷氨酰胺基团结合,并且高度相关。ZNF789中的rs148982377和ZSCAN25中的rs45446698(转录因子)与同一组九种类固醇激素代谢物相关,主要是脱氢表雄酮和雄酮的结合物。
在基因水平的分析揭示了更高程度的多效性和多基因性。使用单核苷酸多态性数据库(dbSNP)的注释,我们确定了基因和代谢物之间的关联:182种代谢物与至少一个基因相关,总共确定了123种显著的基因。其中,有35种基因(27.8%)与多种代谢物相关。个体多效性基因倾向于与具有相似生化性质的代谢物相关,为未鉴定的代谢物提供了见解。例如,UGT1A1、UGT1A3、UGT1A4、UGT1A5、UGT1A6、UGT1A7、UGT1A8、UGT1A9和UGT1A10的基因簇与10种代谢物相关,包括胆红素、胆绿素和五种未鉴定的化合物。这些基因编码尿苷二磷酸-葡萄糖醛酸转移酶(UGT)酶,它们代谢胆红素。与我们的结果一致,Metabolon后来确定这五种未鉴定的化合物是胆红素的降解产物。除了多效性,我们还观察到一些代谢物存在多基因关联的情况。例如,乙基丙二酸,一种丁酸的降解产物,与六个不同的基因显著相关:ACADS、SPPL3、CABP1、OASL、DYNLL1和MLEC。
为了确定肠道微生物组和循环血液代谢物水平之间的关联,我们使用中心对数比(CLR)转换的细菌属水平丰度作为独立变量进行回归,同时校正性别、年龄、性别-年龄交互作用、BMI和遗传亲缘关系(即遗传距离矩阵的前五个主成分)。在测试的代谢物中,大多数与肠道微生物组中至少一个细菌属有显著关联(508/930 = 54.6%,FDR校正P < 0.05)。在这里,平均解释方差的分数(R²)低于遗传关联(训练集中微生物组和宿主遗传特征的平均R²分别为0.04和0.11;验证集中分别为0.02和0.09)。然而,由于使用了不同的显著性阈值(全基因组关联研究(GWAS)使用Bonferroni校正,微生物组使用FDR校正),这些R2值在基因组和微生物组模型之间不是直接可比的。
血液代谢物中,由微生物特征解释的差异最大的部分是由参与细菌对芳香族和酚类化合物代谢的化合物占据的,如肉桂酰甘氨酸、3-苯丙酸(羟基肉桂酸)和马尿酸(训练队列中R² > 0.25,验证队列中R² > 0.15)。苯丙氨酸和苯乙酸被分解为肉桂酸和苯甲酸是微生物组的特有功能,在无菌小鼠中明显缺失。马尿酸是在肝脏中由苯甲酸与甘氨酸结合形成的,马尿酸的血液水平与肠道微生物组α-多样性和整体代谢健康都呈正相关。
此外,我们还发现了一些细菌蛋白质发酵的产物,如对甲酚衍生物和色氨酸降解产物吲哚丙酸,与肠道微生物组相关。此外,我们发现所有在血浆中鉴定的次级胆汁酸都与肠道微生物组显著相关(FDR校正P < 0.05),这是预料之中的,因为初级胆汁酸主要是由肠道共生菌表达的胆盐水解酶解结合成次级胆汁酸。在这里,异熊去氧胆酸盐的差异有最大的一部分由肠道微生物组组成解释(训练队列和验证队列中的R²分别为0.36和0.3)。
本研究的R2估计与以色列队列的先前估计在微生物组-代谢物关联方面表现出良好的一致性(Pearson r = 0.5;图1f),在基因组-代谢物关联方面表现出优异的一致性(Pearson r = 0.9;图1f)。在队列间,微生物组-代谢物方差的最大差异主要观察到在黄嘌呤衍生物上,这可能是由于不同的微生物组测序策略、混杂因素调整、不同的统计建模方法或血清和血浆(本研究)之间的差异所致。
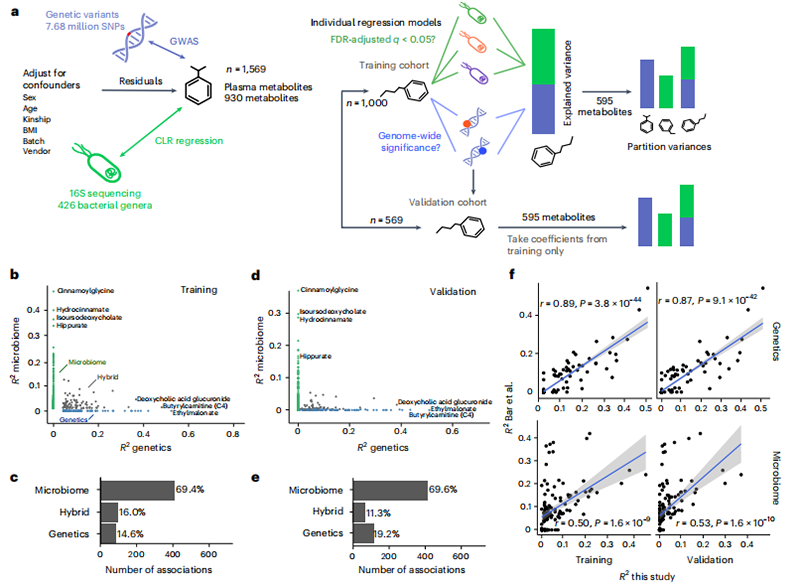
图1 研究设计和由宿主遗传学、肠道细菌属或两者解释的代谢物的横断面差异
遗传和微生物因素的附加贡献
我们共鉴定了930种血浆代谢物中的595种(64%),它们与遗传因素、微生物因素或两者都相关(图1a,b)。其中大部分代谢物(508种)与微生物组显著相关:在训练队列和验证队列中,分别有16.3%和11.4%的代谢物显示出“混合”关联,这意味着它们与遗传和微生物因素都显著相关(即两组特征都解释了>1%的总解释方差;图1b-e)。特别是,我们发现,所有具有显著遗传关联的代谢物中,大约有三分之一到一半也显示出微生物关联(即,在训练队列和验证队列中,分别有161种和160种与遗传变异相关的代谢物中的82种和57种)。相反,在所有与微生物组相关的代谢物中,最多只有五分之一在训练队列和验证队列中也显示出与宿主遗传的混合关联。与上述遗传和微生物组报告的代谢物平均解释方差一致,具有特别大的总解释方差(即>20%)的混合代谢物倾向于具有比微生物更高的遗传R²值(图1b,d和2a)。然而,如上所述,由于微生物组和遗传关联测试使用了不同的显著性阈值,这些模式应该谨慎解释。
为了测试遗传和微生物因素是否包含了冗余的信息,我们将联合遗传-微生物组模型与单独的遗传和微生物模型进行了比较。如果遗传和微生物特征集之间解释的方差重叠较大,那么联合模型的R²值将明显小于单独模型R²值的总和(图2a)。虽然我们发现,在非常多的模型中,联合模型和单独模型R²值之和之间的R²差异在验证队列中具有统计学意义,但这种差异的大小非常小(R²中位差异<0.003),表明遗传和微生物组解释了给定代谢物差异的几乎独有的成分。这一结果与先前的工作一致,表明由微生物组和宿主遗传解释的血液代谢组差异在很大程度上是正交的。然而,在这里我们证明,这不仅在全局上是正确的,而且在个体代谢物水平上也是正确的。
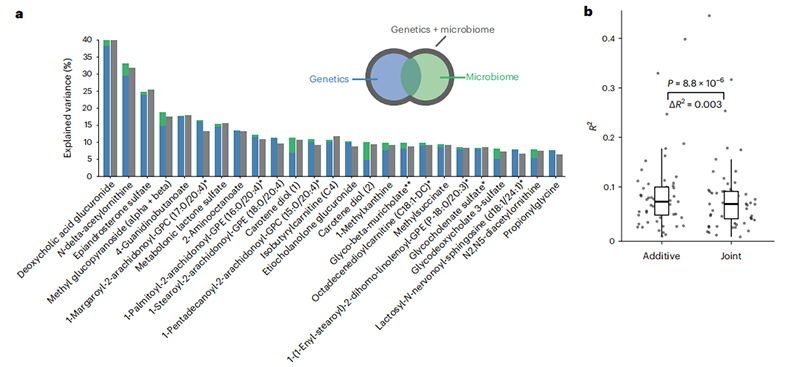
图2与遗传和微生物组相关的代谢物
基因组-微生物组相互作用影响代谢物
最后,我们研究了宿主的遗传背景是否能够调节微生物组-代谢物关联(图3a)。为此,我们在我们的完整队列(n = 1,569)中测试了所有的遗传变异-细菌属-代谢物三元组,只过滤出那些在GWAS中先前检测到的变异-代谢物对(即总共23,126个三元组)。我们采用了类似于基因-环境交互研究的策略,使用CLR转换的微生物属丰度作为环境变量,同时校正上述提到的协变量。总共有466个交互效应被认为在FDR校正P值截止值0.05下是显著的,涉及69种不同的代谢物。虽然基因-微生物组交互作用相当常见,但这些在所有基因型中只解释了很小一部分的血浆代谢物变异性(平均R² = 0.005)。然而,在次等位基因纯合子基因型中,基因-微生物组-代谢物交互作用经常显示出可观的R²,它们解释了高达16%的代谢物变异(图4)。
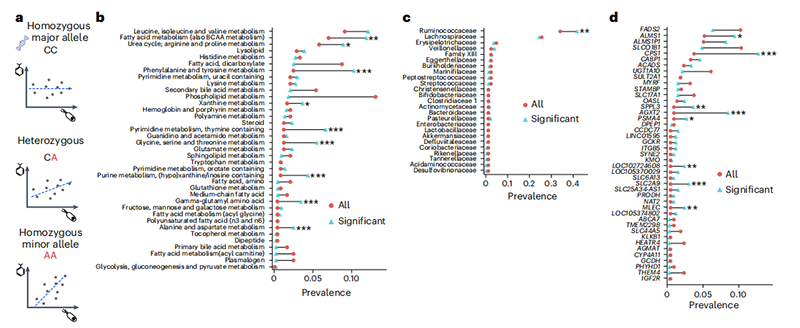
图3基因组-微生物组相互作用影响代谢物
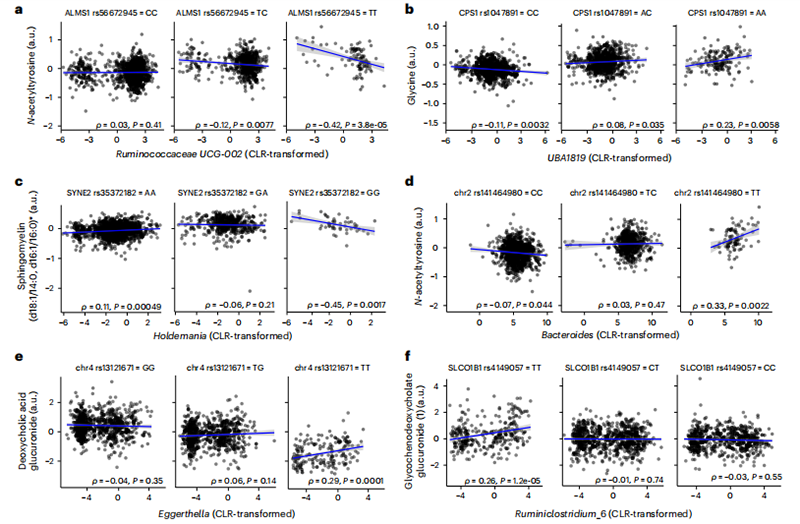
图4基因-微生物组相互作用解释了血液代谢物水平的变化。
基因-微生物组交互作用在参与脂肪酸、苯丙氨酸和酪氨酸代谢、嘧啶和甘氨酸的代谢物中显著富集(图3c;单侧超几何检验,FDR校正P < 0.05),并在几个宿主基因中显示出富集,包括CPS1、AGXT2和SLC2A9(图3e;单侧超几何检验,FDR校正P < 0.05)。此外,我们还观察到涉及瘤胃球菌科(Ruminococcaceae)的交互作用的富集(图3d)。我们观察到一些临床相关的代谢物,在次等位基因纯合子基因型中显示出更强的微生物-代谢物关联。例如,我们看到了与涉及多种疾病状况的代谢物的交互作用,包括肝功能衰竭、丝裂原增多、癌症和炎症性疾病(见补充表3)29-31。特别是,N-乙酰酪氨酸水平与瘤胃球菌科UCG-002和拟杆菌属(Bacteroides)相关,但只在ALMS1基因和染色体2上一个未确定的位点的变异的次等位基因纯合子基因型中(图4a,e)。甘氨酸水平从CPS1基因中一个位点的主等位基因纯合子基因型中与瘤胃球菌科UBA1819呈现出轻微的负相关,转变为在次等位基因纯合子基因型中呈现出更强的正相关(图4b)。作为最后一个例子,神经鞘脂水平与Holdemania相关,但只在SYNE2基因中一个变异的次等位基因纯合子基因型中(图4c)。所有选定的交互作用也可以在未校正的数据中观察到(扩展数据图2)。
共轭胆汁酸的遗传学研究
在将血浆代谢物变异性映射到遗传和微生物因素之后,我们现在询问是否观察到的差异解释的分割可能沿着涉及宿主-微生物共代谢的途径发生变化。为此,我们研究了次级胆汁酸的代谢。次级胆汁酸是通过微生物对初级胆汁酸的解结合在大肠中形成的,然后通过门静脉重新吸收到血液中,并在肝脏中进一步代谢。因此,血液中的次级胆汁酸水平受到微生物组和宿主的影响。我们研究了单个胆汁酸物种的差异是主要由遗传因素、微生物因素还是两者都解释的。
虽然非结合型次级胆汁酸只与肠道微生物组相关,但在检测到的六种次级胆汁酸结合物中,有四种在训练队列和验证队列中都显示出强烈的遗传成分(图5a)。特别是,血浆中的脱氧胆酸和甘氨胆酸的丰度没有显著的遗传贡献,而宿主结合的脱氧胆酸葡萄糖苷和宿主结合的甘氨脱氧胆酸葡萄糖苷的差异有>40%和>20%分别由宿主遗传解释(图5b)。其他葡萄糖苷化的非胆汁酸化合物,如对甲酚葡萄糖苷,没有显示出这种模式(见补充表1和2)。诸如葡萄糖苷化或硫酸化等修饰通常发生在肝脏中,并用于将代谢物标记为在粪便或尿液中排泄。这些结果表明,血液中的结合型次级胆汁酸水平受到强烈的遗传控制,而非结合型次级胆汁酸水平则不受影响。
大多数经过肝脏修饰的次级胆汁酸都与遗传和微生物特征相关。一个例外是甘氨脱氧胆酸葡萄糖苷,它只与遗传相关,而不与微生物组相关,尽管其非结合形式,甘氨脱氧胆酸,只与微生物组相关(图5a)。这一结果在训练队列和验证队列中以及Bar等人的数据集中都是一致的,在这里可以观察到葡萄糖苷化后同样发生了遗传关联的转变(图5a-c)。基因组变异rs4149056与六种修饰的次级胆汁酸中的三种相关,之前已经显示它影响了血浆中胆汁酸的丰度(图5e)。这个变异位于溶质载体蛋白SLCO1B1中,它在肝脏中表达,转运次级胆汁酸,对硫酸化胆汁酸和胆盐有偏好。SLCO1B1中的其他几个变异也与次级胆汁酸衍生物相关。两种检测到的葡萄糖苷化次级胆汁酸与不同的单核苷酸多态性(SNPs)集合相关。甘氨脱氧胆酸葡萄糖苷的血浆丰度主要受到SLCO1B3-SLC1B7基因簇中的变异的影响,而我们发现了几个位于4号染色体上的变异,其中许多位于TMPRSS11E编码丝氨酸蛋白酶的基因(以及一些基因间变异),它们特别影响了脱氧胆酸葡萄糖苷水平(图5e)。
此外,我们还鉴定了至少两个显著的基因组-微生物组-代谢物交互作用,影响了脱氧胆酸葡萄糖苷和甘氨脱氧胆酸葡萄糖苷的水平。4号染色体上的一个未确定的变异与次等位基因纯合子基因型中的脱氧胆酸葡萄糖苷水平降低相关,但这种效应在肠道微生物组中埃格氏菌(Eggerthella)水平较高的个体中被缓解(图4d)。此外,SLCO1B1基因中的一个变异只在主等位基因纯合子基因型中与瘤胃闭合菌(Ruminoclostrium)呈正相关,尽管这个“主”等位基因在我们的队列中实际上并不常见(图4e)。
因此,尽管未修饰的次级胆汁酸水平的横断面变异不能用宿主的遗传变异来解释,但血浆中几种次级胆汁酸结合物的丰度与4号和12号染色体上一组多样的化合物特异性遗传变异显著相关。此外,我们观察到,未修饰的脱氧胆酸和宿主结合的脱氧胆酸葡萄糖苷与互斥的细菌属集合相关,尽管它们共享相同的次级胆汁酸骨架(图5d)。

图5 宿主遗传和肠道微生物与次级胆汁酸的关系
鞘氨醇和神经酰胺表现出异质性关联
我们接下来询问是否在另一种与疾病相关的血液代谢物类别中也会常见到杂交关联:神经酰胺。高神经酰胺水平已被证明与胰岛素抵抗、高胆固醇血症、肝脂肪变性和脂质筏的形成有关。此外,血液中的某些类别的神经酰胺会增加晚发型阿尔茨海默病的风险,因为它们具有神经毒性并诱导细胞凋亡。神经酰胺是最简单的鞘磷脂,由来自鞘氨醇的新生合成或鞘磷脂分子的水解形成。虽然神经酰胺在细菌中很少发现,但是拟杆菌门中的许多细菌可以合成鞘磷脂,这些鞘磷脂已被证明可以被体外的人类上皮细胞摄取和处理。因此,我们询问血液中神经酰胺和鞘氨醇衍生物水平的变异是否可以显著地由微生物属、宿主遗传因素或二者的组合来解释。
我们观察到神经酰胺和鞘氨醇分子的差异分配中存在很大程度的异质性(图 6)。鞘氨醇本身的差异只能由肠道菌群的组成(R² = 0.01)微弱地解释,链球菌是唯一显著的与菌群相关的关联。然而,神经酰胺合成过程中的其他中间体,如鞘氨醇衍生物,显示出更强的菌群和基因组关联(即在训练和验证队列中,分别有高达 5% 和 2% 的差异被解释;图 6a,b)。神经酰胺显示出一系列广泛的可解释差异。虽然大多数神经酰胺与肠道菌群相关,但有一小部分具有额外的遗传成分,如乳糖基-N-神经酰胺和神经酰胺(d16:1/24:1,d18:1/22:1),这两种脂质物种都有超过 5% 的变异由训练和验证队列中的遗传因素解释。这两种脂质物种都是非常长链脂肪酰基鞘磷脂的例子。虽然较短的脂肪酸(≤C18)在人类饮食中普遍存在,通常作为某些肠道微生物合成神经酰胺的优先底物,但较长链的脂肪酸,如神经酸(24:1),通常是宿主酶延伸的产物,在被掺入主要存在于脑组织中的鞘磷脂之前。这一结果在 Bar 等人中得到了证实,他们观察到只有短链鞘磷脂与菌群相关。总之,我们观察到菌群和宿主遗传因素解释的方差分数存在广泛的异质性,其中脂肪酸链长的差异可以区分与肠道微生物属相关的循环神经酰胺(即,较短的链)和与宿主遗传因素相关的神经酰胺(即,较长的链)。
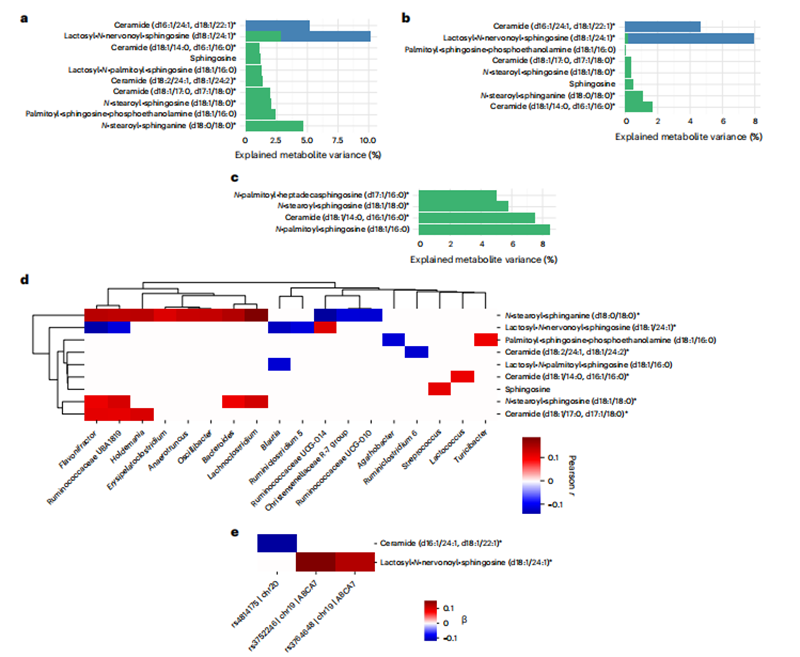
图 6宿主遗传和肠道微生物与鞘氨醇、神经酰胺的关系
讨 论
在这项研究中,我们将 1,569 名一般健康的美国居民的个体血液代谢物水平中的横断面差异分解为宿主遗传和肠道菌群组分,这些居民具有配对的基因组、菌群和血液代谢组数据。以前的研究已经证实,血浆代谢组与宿主遗传和肠道菌群密切相关,而且代谢组上的总体遗传和微生物影响似乎是正交的。类似地,我们量化了给定代谢物的微生物和遗传差异成分之间的重叠,并发现它是显著的,但非常小(解释方差的<0.03%)。这一结果对孟德尔随机化研究有重要意义,这些研究依赖于这种重叠(即非可加性),并解释了为什么以前的研究需要非常大的队列来检测很少的可能具有因果关系的效应。
迄今为止,尚不清楚遗传和菌群是影响人类血液中互斥的代谢物集合的水平,还是同时作用于单个代谢物。在检测到的血液代谢物中(930 种中的 508 种),大多数显示出与肠道菌群有显著的关联。我们发现,杂交基因组-菌群模型很常见,影响了与宿主遗传或菌群相关的所有代谢物中约 10-16% 的代谢物。要对这一比例进行更准确的估计,需要比这里展示的更大规模的研究,因为杂交关联在具有小菌群方差成分(R² < 0.02)的代谢物中富集,其中许多我们可能无法检测到(例如,由较小的验证队列中杂交情况的比例较低所说明)。我们观察到,与宿主遗传相关的血液代谢物中,有三分之一到一半包含了与肠道菌群有显著的杂交关联,而只有五分之一与菌群相关的代谢物显示出其方差中有额外的杂交遗传成分。因此,虽然遗传和菌群变异对解释血液代谢组中的变异都很重要,但菌群(以及与菌群变异相关的无数因素,如饮食和生活方式)似乎是循环代谢物变异背后的主导驱动力。
此外,我们还发现了一些基因-菌群相互作用的证据,其中特定的代谢物-菌群关联受到宿主遗传背景的调节。一般来说,这些相互作用只能解释代谢物方差的很小一部分(即<2%)。然而,这些相互作用往往是由同源的次等位基因型内部的相对强的关联导致的,但我们只有有限数量的这些次等位基因携带者可用于对这些关联进行稳健的评估。话虽如此,如果我们在同源的次等位基因型内部观察,我们发现一个代谢物的方差中有高达 16% 是由给定的细菌属解释的。特别是,N-乙酰-酪氨酸、甘氨酸和鞘磷脂的丰度与一组不同的肠道细菌属显示出强烈的关联,但只在同源的次等位基因型中。因此,看起来由遗传决定的对特定数量性状的偏离可能被肠道中特定的微生物群落组成调节,甚至诱导。这种基因组-菌群相互作用效应可以帮助指导微生物群靶向治疗药物的设计,以减轻宿主遗传疾病风险。例如,我们发现甘氨酸丰度受到 24 个基因-菌群-代谢组相互作用的调节(图 4a 和补充表 3),其中大多数涉及 CPS1 基因的变异。甘氨酸依赖是癌细胞增殖的标志,限制甘氨酸和丝氨酸可以减少小鼠异种移植和同种移植模型中肿瘤的生长。因此,在具有 CPS1 基因中观察到的变异体的个体中进行微生物群靶向干预可能有益于降低循环甘氨酸水平。然而,考虑到次等位基因的普遍低发生率和肠道细菌群落组成的高度异质性,需要有针对性的干预研究来验证这些相互作用在体内的有效性。
以前对血液中来源于微生物前体的微生物-宿主共代谢物的研究,如尿素或对甲酚硫酸盐(即微生物来源的代谢物在肝脏中修饰的形式),暗示了这些分子的横断面差异可能只与菌群相关,而不与宿主遗传相关。在这里,我们显示了这些观察结果并不适用于所有的微生物-宿主共代谢物。事实上,我们发现,许多来源于肠道微生物前体的代谢物的横断面变异中有很大一部分是由宿主遗传解释的。例如,虽然血液中未结合的次级胆汁酸只与肠道菌群相关,但它们在肝脏中形成的葡萄糖醛酸或硫酸盐衍生物,往往受到宿主遗传变异的强烈影响。在当前研究队列中,脱氧胆酸葡萄糖醛酸盐水平的大部分差异可以由遗传和微生物因素的组合来解释,而未结合的脱氧胆酸则仅与菌群相关。脱氧胆酸和脱氧胆酸葡萄糖醛酸盐都显示出与菌群的关联,但这些关联是与不同的细菌属相关的。葡萄糖醛酸化促进了尿液和粪便中的排泄,以前在大鼠中的工作表明,葡萄糖醛酸化的胆汁酸比肠道中未修饰的次级胆汁酸吸收效率低。肠道后基因组编码了多种β-葡萄糖醛酸化酶,这些酶可能使肠道共生菌能够利用这些与胆汁酸结合的葡萄糖醛酸盐作为碳源。相反,游离的次级胆汁酸对许多细菌类群有毒。因此,胆汁酸可以通过作为促进生长的碳源或抑制生长的有毒化合物,直接驱动肠道菌群的变化,这可能解释了与同一次级胆汁酸的结合和未结合形式相关的肠道属的非常不同的子集(图 5d)。
我们的分析中另一个有趣的发现是,某些血浆鞘磷脂与宿主遗传或肠道菌群的可变关联,取决于构成每种脂质物种的脂肪酰基团。具有≤C18 脂肪酰基团的神经酰胺与肠道菌群显示出更强的对应关系,这与这些脂肪酸在饮食中的高发生率以及它们被某些肠道类群优先掺入神经酰胺的情况一致。另一方面,具有非常长链脂肪酰基团(22:1,24:1)的神经酰胺,它们在脑组织中最丰富,通常通过宿主酶的延伸合成,与宿主遗传显示出更强的对应关系。重要的是,具有不同脂肪酰链长度的神经酰胺已被涉及到许多人类疾病中,包括阿尔茨海默病、抑郁症和情绪障碍。区分哪些神经酰胺受到饮食和肠道菌群的控制,哪些受到遗传倾向的影响,可能有助于设计新的和改进的精准治疗药物。
应该注意的是,目前的研究只包括来自美国和主要是欧洲血统的个体。虽然我们的结果与以色列和瑞典的队列获得的结果一致,但未来需要在更多样化的人群中进行研究,以确定所报告的观察结果是否能更广泛地复制。最后,虽然我们在回归分析中包括了许多高度相关的协变量(即年龄、性别、BMI 和遗传背景),但许多观察到的微生物-代谢物关联可能与生活方式和饮食习惯混淆,这些习惯在目前的研究人群中没有得到全面的跟踪,并且可以强烈影响肠道菌群的组成。
总的来说,我们的分析表明,血浆代谢组受到遗传和微生物因素之间相互作用的影响,其中在肠道中吸收的单个微生物来源的代谢物的丰度通常受到宿主遗传和肠道生态两方面变异的叠加影响。此外,许多微生物-代谢物关联取决于宿主遗传背景。这些杂交基因组-菌群-代谢组模型为人类血液代谢组中的变异背后的力量提供了独特的见解,并可以提出可能的治疗策略。具体来说,我们建议与菌群强相关的与疾病相关的血液代谢物可能通过饮食、益生菌、益生元或生活方式干预来改变,而受强遗传控制的代谢物可能需要针对宿主代谢途径的药物干预。了解这些循环小分子中哪些主要受到宿主还是菌群的控制,将有助于指导旨在预防和/或治疗一系列疾病的干预措施。
本文译自:
Christian Diener et al. Genome-microbiome interplay provides insight into the determinants of the human blood metabolome. Nat Metab. 2022 Nov;4(11):1560-1572.