
概要
通过阴道分娩婴儿会被母亲的肠道菌群定植。剖腹产(CS)分娩会干扰母亲到新生儿的菌群传播。在这项研究(NCT03568734)中,我们评估了是否可以通过产后口服肠道菌群移植(FMT)来恢复足月剖腹产婴儿的肠道菌群发育。我们招募了17名母亲,其中7名经过仔细筛选后被选中。她们的婴儿接受了来自自己母亲的稀释粪便样本,该样本在分娩前3周取得。所有7名婴儿在3个月的随访期间都没有出现任何临床问题,也没有出现任何不良反应。FMT治疗的剖腹产婴儿的肠道菌群组成的时间发展不再类似于未经治疗的剖腹产婴儿,而是与阴道分娩婴儿有显著的相似性。这项概念验证研究表明,剖腹产婴儿的肠道菌群可以通过母亲FMT在产后恢复。然而,这只能在经过仔细的临床和微生物学筛查后进行。
介绍
新生儿的微生物定植是一个影响后期健康的关键过程(Stiemsma and Michels, 2018)。深度宏基因组学分析(Bäckhed et al., 2015)和最近的菌株水平分析显示,阴道分娩婴儿肠道的主要早期定植者是母亲的粪便细菌,主要是双歧杆菌和拟杆菌的成员(Nayfach et al., 2016; Asnicar et al., 2018; Ferretti et al., 2018; Korpela et al., 2018a; Shao et al., 2019)。断奶后, 肠道菌群逐渐由主要的厌氧梭菌占据(Bäckhed et al., 2015)。这种一般模式在不同的人群中都很明显,可能代表了一个与正常人类发育密切相关的生物学决定的现象(Korpela and de Vos, 2018)。因此,很可能人类系统已经适应了在某些时间窗口接收特定的微生物信号,以进行早期生活中的相互免疫和代谢编程(Maynard et al., 2012; Gensollen et al., 2016; Olin et al., 2018)。
阻止母亲传播菌群或改变婴儿肠道菌群的做法,可能会干扰自然的微生物定植和发展。剖腹产(CS)分娩是正常定植过程最强的干扰因素之一。这种做法有效地消除了母亲在分娩时将肠道菌群从母亲传递给婴儿的可能性,导致肠道菌群发育的偏离,最明显的是在生命的前6个月(Bäckhed et al., 2015; Ferretti et al., 2018; Korpela et al., 2018a; Korpela and de Vos, 2018)。
剖腹产在全世界范围内不断增加,影响超过50%的婴儿。在某些地区,有越来越多的证据表明,剖腹产婴儿有不同的菌群和其他暴露,可能会微妙地改变新生儿的生理状态(Boerma等,2018; Sandall等,2018)。几项研究表明,剖腹产分娩与短期和长期效应相关,包括慢性免疫疾病风险增加(Sevelsted等,2015; Keag等,2018)。然而,关于剖腹产分娩效应仍存在争议,应该注意的是,早产、使用抗生素和其他混杂因素可能会影响报告的相关性。一些大型研究,尤其是在斯堪的纳维亚地区,发现剖腹产分娩与特定疾病,如1型糖尿病无关(Samuelsson等,2015; Clausen等,2016)。相反,最近一项基于丹麦的研究涉及1982–2010年间的250多万次分娩,最长达40年的随访显示,与阴道分娩儿童相比,剖腹产儿童患四种常见的、以免疫为基础的儿童慢性炎症性疾病的风险增加,包括炎症性肠病、类风湿性关节炎、乳糜泻和1型糖尿病(Andersen等,2020)。值得注意的是,最近一项基于英国的大型队列研究显示,剖腹产婴儿肠道菌群发育受阻,致病菌水平升高,并且母亲到婴儿的菌群转移受损(Shao等,2019)。除了对个体的影响,这种普遍缺乏垂直菌群转移可能有代际效应;当母亲到女儿的肠道菌群转移被消除时,是否有可能永久地丢失了某些与宿主共同适应了数千年的互利细菌(Blaser, 2017)。
肠道菌群对整体儿童发育的重要性越来越多的证据引起了对早期纠正剖腹产引起的菌群失衡的需求。因为婴儿肠道通常在出生时被母亲肠道微生物定植,所以为剖腹产婴儿移植菌群最自然的移植物是母亲粪便物质。在这项研究中(在临床试验中注册为NCT03568734),我们调查了母亲对自己婴儿进行肠道菌群移植(FMT)(Smits等,2013)是否安全有效地恢复了正常肠道菌群及其在早期生活中的发展。
结果
剖腹产婴儿的母体肠道菌群移植
在这项研究中(在临床试验中注册为NCT03568734),共有17名计划剖腹产的孕妇参与了产后给婴儿进行FMT。根据欧洲FMT的共识建议(Cammarota等,2017),我们进行了广泛的筛选,并根据新生儿的情况做了一些修改,包括B型链球菌(GBS)携带状态分析(STAR方法;表S1)。7名母亲被选中。所有母亲都在37周(±3天)的胎龄分娩,并且至少纯母乳喂养了2个月(表S2)。M11婴儿的母亲在分娩后32天开始口服头孢氨苄治疗乳腺炎7天,除此之外,其他母婴没有接受抗生素治疗,除了所有计划剖腹产的女性在切口前30-60分钟接受一次静脉注射1.5克头孢呋辛。剖腹产后,7名被选中的新生儿,5名女孩和2名男孩,接受了自己母亲的粪便移植物,该移植物以5毫升的剂量随第一次人乳喂养方式给予。婴儿在产科病房随访了2天,并评估了他们的炎症标志物(表1)。FMT治疗的婴儿平均出生体重为3240 ± 285克,身高为49.9 ± 1.7厘米。所有婴儿都很健康,平均APGAR评分为9 ± 1。所有婴儿都接受了3.5毫克的移植物,除了一个婴儿(M6),他接受了7毫克的移植物。厌氧培养表明,单剂量大约含有0.7 x106–16x106个活细菌细胞(表1)。
虽然其他所有新生儿在出生后48小时内的C反应蛋白(CRP)都在10毫克/升或以下(表1),但M6婴儿的CRP值为67毫克/升。这个婴儿没有与感染相关的临床症状,随访第二天,CRP降至39毫克/升,婴儿出院时没有开始抗菌治疗。虽然临床上无关紧要,但由于CRP的增加,后续的所有婴儿都接受了3.5毫克的移植物,没有观察到CRP的增加(表1)。
婴儿的临床过程平稳无事。在产科病房的随访期间,没有观察到体温升高。在第4周随访时,三名新生儿(M4、M8和M12)的父母报告了轻微的胃肠道症状。其他四名父母没有报告任何胃肠道症状。总体而言,父母没有报告任何其他可能与治疗有关的症状、疾病或需要看医生的情况,表明FMT在3个月龄时没有引起任何不良健康影响。治疗后婴儿在3个月时的体重(5702 ± 525克)处于正常发育范围内(表1;表S3)。
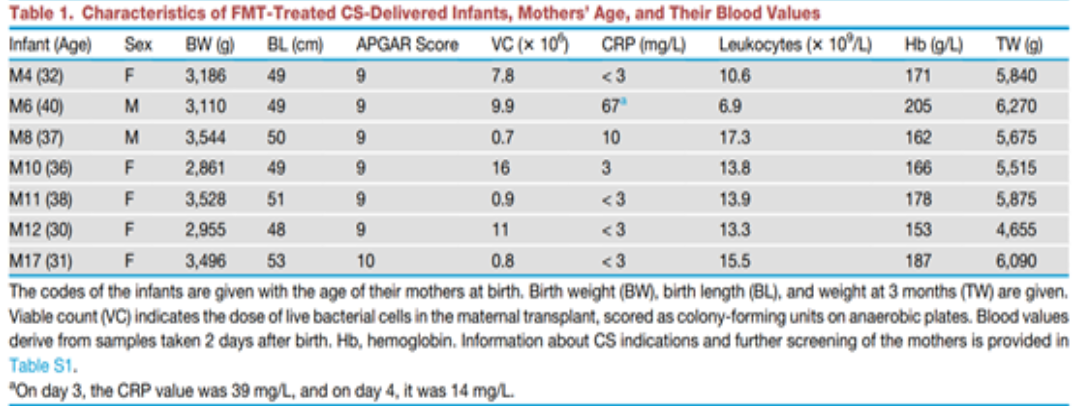
剖腹产婴儿的母体肠道菌群移植可选择性定植
由于FMT治疗的婴儿的健康和发育都正常,我们重点分析了他们的肠道菌群,通过16S rRNA基因扩增子测序和与他们母亲的菌群进行比较(图1)。出于程序和科学的原因,我们使用了母亲在分娩前3周产生的新鲜粪便样本(样本编码为Mother A)来制备移植物(样本编码为Transplant),并将其与母亲在分娩前几天捐赠的样本(样本编码为Mother B)进行了菌群组成的比较。正如预期的那样,对于成年人来说,这些母亲样本中的菌群是高度相似的,但明显不同于无监督主坐标分析(PCoA)可视化中的婴儿样本中的菌群(图1)。胎粪样本中的菌群与任何粪便样本都不同。在第2天后收集的婴儿样本在组成上相当相似(图1)。
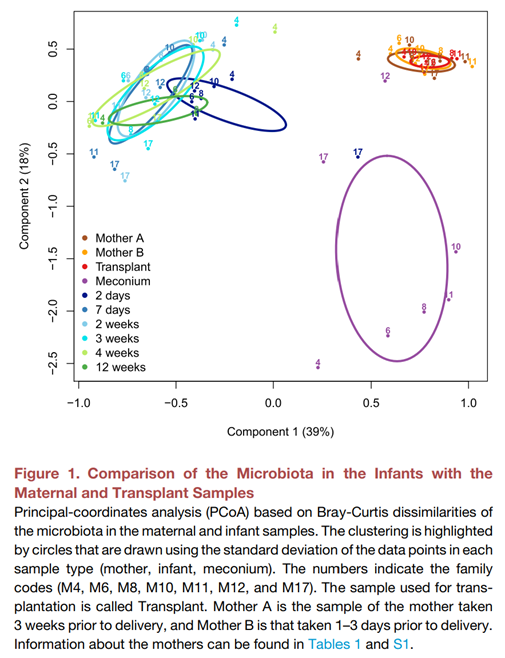
FMT治疗的婴儿样本中的菌群与捐赠移植物的母亲的菌群非常不同,表明移植后有高度选择性的定植(图2)。母亲的菌群具有成人特征的组成,以瘤胃球菌科和毛螺菌科为主。胎粪样本中主要由产气单胞菌属占据,除了M12和M17婴儿,他们有更多样的组成类似于粪便样本。7名婴儿中有6名显示出统一的菌群发展,拟杆菌属和双歧杆菌属迅速升至优势地位,而M17婴儿则有高丰度的肠杆菌属/大肠杆菌属、链球菌属和维氏菌属。值得注意的是,这些细菌已经存在于M17的胎粪中。在第2天的粪便样本中,菌群几乎完全由拟杆菌属(M10和M11)或大约一半的拟杆菌属与未培养的酸胺菌科(M4)、丁酸单胞菌科和肠球菌属(M6;这个婴儿在那天CRP升高),或沼泽杆菌属(M8),或肠杆菌属/大肠杆菌属(M12)占据。M17婴儿在第2天保持了多样性的组成。拟杆菌属在所有婴儿中随着年龄的增长而下降,除了M17,在他们中观察到了拟杆菌属的增殖。到了7天时,除了两个婴儿(M17和M11),他们被肠杆菌科占据,双歧杆菌在所有婴儿中成为了优势群体。双歧杆菌在所有后续样本中保持丰富,除了4周时的M6和M17婴儿,在他们中肠杆菌科和拟杆菌属丰富。
剖腹产婴儿的母体粪便微生物菌群移植后的菌群发育类似于阴道分娩婴儿
为了将FMT治疗的婴儿样本与未经治疗的婴儿的代表性数据进行比较,我们又收集了82个阴道分娩和剖腹产的全母乳喂养婴儿的样本(表2;表S2),并按照相同的方法处理和分析了菌群组成(图2)。由于我们的伦理许可不允许我们在第2天抽血并比较其他婴儿的CRP水平,但在平均出生体重、3个月时的体重或3个月内的体重增长方面,各组之间没有观察到差异(表S3)。大多数FMT治疗的剖腹产婴儿接受了益生菌(表2)。这些主要包括利氏乳杆菌,它存在于一种常用的维生素D补充剂中,根据芬兰的国家计划,从2周开始给予婴儿。这种干预在FMT治疗的剖腹产出生婴儿或接受了这种益生菌(32个3周或更晚样本;表2;表S2)的对照婴儿的菌群中没有观察到任何效果。
FMT治疗的剖腹产婴儿的整体菌群发育更像阴道分娩婴儿,而不是未经治疗的剖腹产婴儿。在生命的最初几天,FMT治疗的婴儿的菌群与阴道分娩婴儿不同(p = 0.03,PERMANOVA),但从第7天开始,FMT治疗的婴儿与阴道分娩婴儿相似,而与未经治疗的剖腹产婴儿不同(表3)。
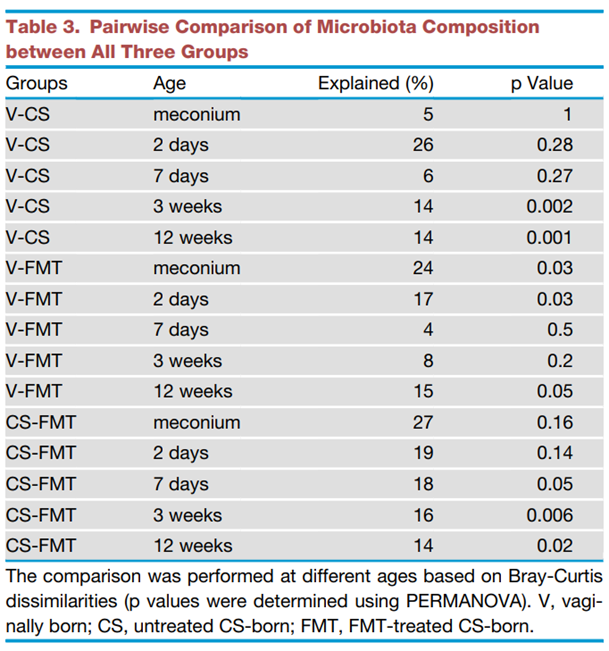
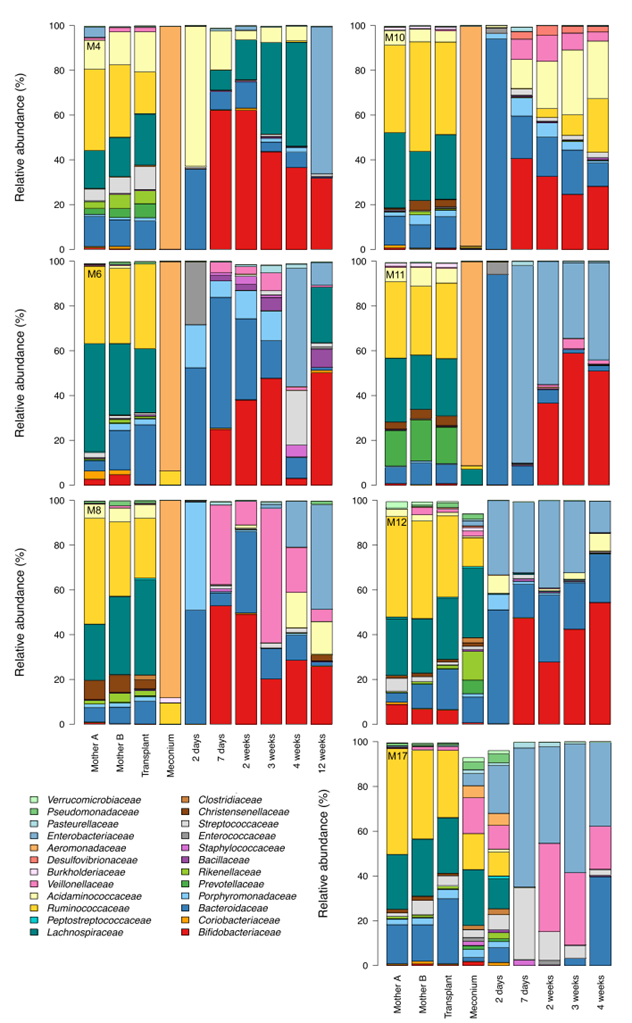
为了进一步详细了解移植治疗婴儿的菌群发育情况,我们测试了阴道分娩婴儿和剖腹产的治疗和未治疗婴儿之间的菌群差异。我们根据益生菌的使用情况(所有对照组婴儿都完全母乳喂养,没有接受抗生素)调整了测试,并通过省略紧急剖腹产的情况进行了敏感性分析。当比较主要菌群科(图3A)和目(图3B)的丰度时,我们观察到,与阴道分娩婴儿相比,剖腹产婴儿始终有显著低的拟杆菌目(主要是拟杆菌属)和双歧杆菌目的丰度,以及乳杆菌目、梭杆菌目和肠杆菌目的丰度增加。这在粪菌移植治疗的剖腹产婴儿中并不是这样(排除了使用的益生菌乳杆菌的潜在影响),而粪菌移植治疗的最显著效果是拟杆菌目丰度的快速正常化。事实上,与FMT组和阴道分娩组相比,CS组中拟杆菌目的丰度在1周和3周时显著降低(p%0.001)。在12周时,FMT组中拟杆菌目的丰度下降。FMT治疗的婴儿在生命的前两天双歧杆菌的丰度非显著降低,之后双歧杆菌的水平与阴道分娩婴儿相当。与阴道分娩和FMT治疗组相比,CS组中梭杆菌科显著升高,尤其是在3周和12周时(p<0.01)。除了主要类群之外,在低丰度类群中也存在组间差异,大多是暂时性的(图S1)。FMT治疗改变了剖腹产婴儿的菌群,使得所有相关菌群的时间发展与阴道分娩婴儿相似。重要的是,潜在病原体肠球菌属、肠球菌属、肠杆菌属、克雷伯氏肺炎杆菌、克雷伯氏氧化钾杆菌、流感嗜血杆菌、弯曲杆菌属和沙门氏菌属的相对丰度在CS组中始终升高,但在FMT治疗组中并不升高(图3B)。CS组和FMT治疗组之间病原体丰度的差异在1周(p<0.0001)和12周(p<0.00001)时显著。
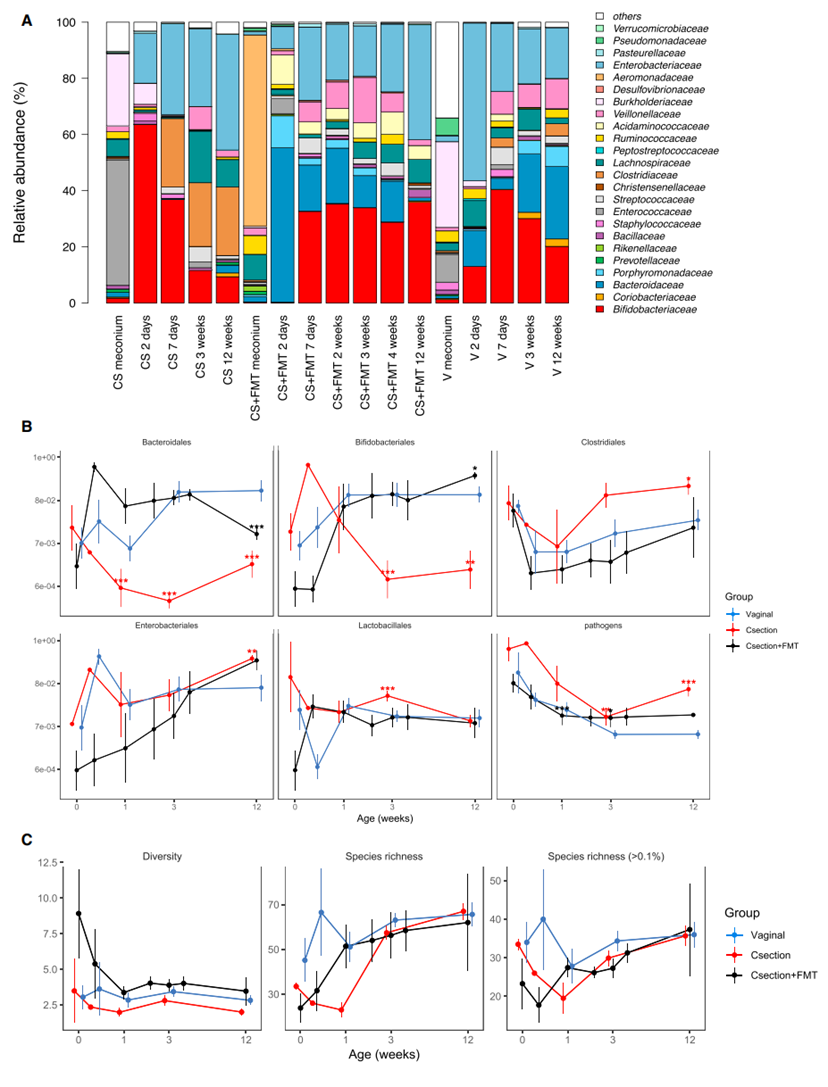

根据反辛普森多样性指数、操作分类单元(OTU)的数量和物种数量来衡量的菌群多样性,与阴道分娩组和FMT治疗组相比,CS组中的多样性倾向于较低(图3C)。FMT治疗增加了多样性,特别是在1周龄时的OTU数量。这是由于非常低丰度的OTU的增加,其中许多OTU映射到相同的分类物种;而丰度较高的物种数量在各组之间相似。
母体粪菌移植而非阴道拭子恢复了剖腹产出生婴儿的菌群
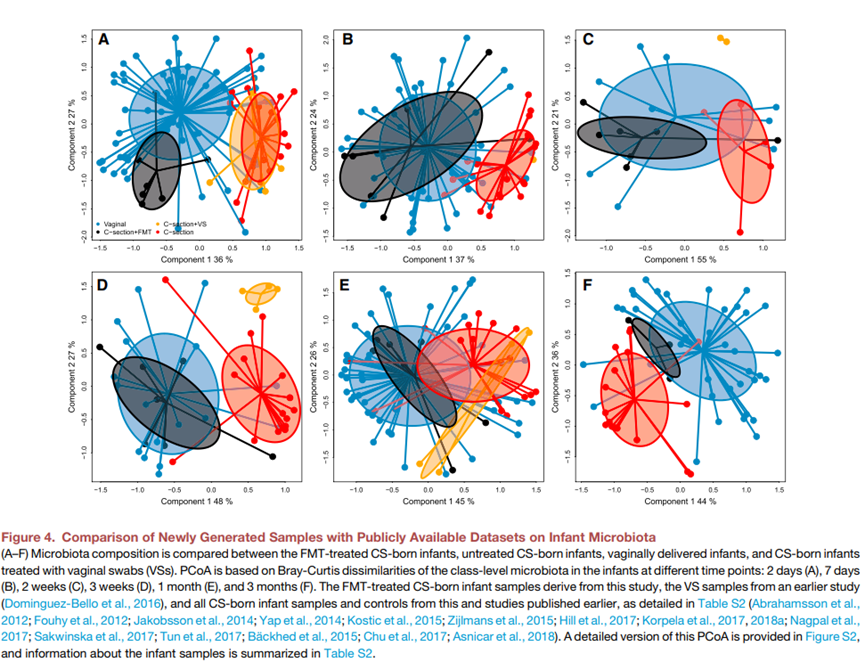
为了概括我们观察到的FMT治疗恢复了剖腹产婴儿的菌群的结果,我们用来自瑞典(Bäckhed et al., 2015)、德国(Korpela et al., 2018a)、意大利(Ansicar et al., 2018)和美国(Chu et al., 2017)的团队的公开可用的菌群数据集扩展了我们的数据。这些数据集总共包括了163个阴道分娩婴儿和38个剖腹产婴儿,以及6个用母体阴道微生物移植过的实验性剖腹产婴儿(Dominguez Bello et al., 2016;表S2)。此外,我们还添加了来自另外12项研究的平均菌群数据,这些研究来自瑞典(Abrahamsson et al., 2012;Jakobsson et al., 2014)、新加坡(Yapet al., 2014;Sakwinska et al., 2017)、芬兰(Kostic et al., 2015;Korpela et al., 2017)、荷兰(Zijlmans et al., 2015;Korpela et al., 2017)、爱尔兰(Fouhy et al., 2012;Hill et al., 2017)、日本(Nagul et al., 2017)和加拿大(Tun et al., 2017)(表S2)。我们在类水平(为简单起见,将变形菌门总结为门水平)对菌群进行了表征,因为这似乎足够抵抗由技术变异引起的偏差,如前文所述(Korpela and de Vos,2018)。这个混合数据集的主成分分析图显示,菌群组成明显地按出生方式聚类(图4)。确认并扩展了早期的观察结果,FMT治疗的剖腹产婴儿的菌群与阴道分娩的婴儿从2天到3个月都聚类在一起。值得注意的是,按照前文所述(Dominguez Bello et al., 2016)用阴道拭子处理过的婴儿样本与未经治疗的剖腹产婴儿聚类在一起(2天、7天、4周),或者与其他任何样本都不相似(2-3周)。这个结果是非常普遍的,不受样本收集国家、益生菌使用、母乳或配方奶喂养、或剖腹产类型(紧急或择期)的影响(图S2)。
讨论
在这项概念验证的初步研究中,我们将母亲的粪便微生物转移给婴儿,以纠正剖腹产婴儿常见的肠道菌群失衡。虽然需要进一步的监测,但所呈现的结果显然是有希望的。7个接受治疗的婴儿中没有一个出现并发症,FMT恢复了菌群的发育,使之与阴道分娩婴儿相似。重要的是,母体FMT纠正了剖腹产婴儿中拟杆菌属缺乏和双歧杆菌发育延迟的情况,这是剖腹产婴儿的特征(Bäckhed et al., 2017;Korpela and de Vos, 2018 Shao et al., 2019)。一项最近的大规模研究证实了剖腹产婴儿中拟杆菌属菌株传播受到干扰(Shao et al., 2019)。有趣的是,与阴道分娩婴儿相比,剖腹产婴儿显示出潜在机会致病菌,如肠球菌、肠杆菌和克雷伯氏菌属等水平升高(Shao et al., 2019)。我们在剖腹产婴儿中观察到了类似的模式,而FMT则缓解了这种情况(图3B)。
我们根据已建立和新开发的标准仔细选择了母亲作为自己婴儿的捐赠者,其中GBS携带状态是最重要的反选择参数。我们没有使用健康的非GBS携带者作为被排除母亲的剖腹产婴儿的捐赠者。然而,在有更多关于这种新方法安全性和潜在健康益处的证据出现时,可以考虑进行粪便菌群异体移植。
我们通过使用人乳作为传递系统,将第一次给剖腹产婴儿喂的奶中移植粪便微生物,开发了FMT程序。这基于一个概念,即粪口微生物转移是一种正常的垂直传播方式(Zoetendal et al., 2001;Sakwinska et al., 2017)。此外,它利用了最近的研究,表明母乳喂养在母亲到婴儿的微生物转移中起作用(Pannaraj et al., 2017),以及母乳中存在大量可培养细胞或其DNA,它们来源于人类肠道中发现的物种(Schwab et al., 2019;Asnicar et al.,2018)。最后,出于简单起见,我们使用了一次移植,用稀释的粪便微生物(相当于3.5或7毫克的移植物(106–107个活细胞))。是否较高剂量与婴儿M6暂时升高的CRP值有关无法确定,但这项初步研究表明,较低剂量是有效的,也没有对受治疗的婴儿造成不良影响。所用的移植物平均含有7x106个活细胞(表1),其数量和变化与稀释的成人粪便微生物所期望的一致(Ben-Amor et al., 2005)。已经很好地确定了大多数女性在分娩过程中会有一定程度的排便(Fraser and Cooper,2009)。这将提供一种可能的移植途径,当卫生措施不像目前在西方世界那样严格时,这种途径可能更明显。值得一提的是,在某些国家,在阴道分娩前有一天禁食或肛门冲洗是惯例。确定这是否也影响母亲到婴儿的微生物转移,这是有意义的。
在这项原理性的研究中,我们选择在母亲分娩前3周,当母亲放松时取新鲜的粪便样本,以快速处理移植物并在实际移植物中进行病原体筛查。在筛查过程中,我们发现29%(17例中的5例)呈阳性,其中4例为GBS,1例为疱疹。此外,还发现了一例可疑的肝炎(表S1)。因此,我们的发现警告不要在没有监督的情况下,由父母驱动的母体微生物转移(阴道或粪便)给新生儿,因为传播有害微生物的可能性似乎很高。相反,未来的工作应该确定适当的剂量,模拟出生时对母体粪便的自然暴露。
我们没有发现移植样本和分娩前3天内取得的母亲粪便样本(母亲B)之间的菌群组成有显著差异(图1)。然而,我们明确地证明了婴儿肠道是一个高度选择性的环境,因为单次母体移植后的微生物组成在2天后发生了剧烈变化(图1)。新生儿菌群的时间发展被归因于细菌群体的有序定植,认为人体不断地从可用的定植者池中进行取样(Costelloet al., 2012;Milani et al., 2016)。然而,在这里我们显示,FMT治疗的剖腹产婴儿中,时间发展是由于母体粪便移植物的选择性定植所导致的。还有待确定,在阴道分娩婴儿中,正常移植是否也是像这里应用的那样单次大量移植,或者是母体微生物多次和连续转移事件的结果。有迹象表明,母体肠道微生物在剖腹产婴儿中以延迟的方式逐渐定植在生命的前几个月,这表明在出生后也存在家庭成员之间的细菌转移(Korpela et al., 2018a)。当母体移植物已经转移时,驱动选择压力的因素可能包括母乳中寡糖(如寡糖化和其他人类乳汁寡糖)以及其他尚待发现的因素(Milani et al., 2017;Korpela et al., 2018a)。其中一些因素可能显示出时间发展,因为在最近的小鼠模型中已经显示,移植物移植时刻决定了最终群落(Martı´nez et al., 2018)。这也可能导致早期菌群时间发展中观察到的变化(Costello et al., 2012;Milaniet al., 2016)。
到目前为止,还没有一种安全有效的方法可以完全恢复剖腹产婴儿的菌群。阴道微生物移植被认为是一种使剖腹产婴儿的肠道菌群自然化的方法(Dominguez-Bello et al., 2016)。然而,在这里我们显示,阴道拭子不能纠正剖腹产引起的菌群失衡。这并不令人惊讶,因为阴道细菌通常不定植于婴儿肠道(Sakwinska et al., 2017;Ferretti et al., 2018)。一些作为益生菌销售的制剂含有双歧杆菌,可能部分地使整体菌群正常化(Korpela et al., 2018c)。然而,阴道分娩婴儿和剖腹产婴儿之间最显著的差异是后者中普遍缺乏拟杆菌属(Bäckhed et al., 2015;Korpela and de Vos, 2018)。这不能通过给予双歧杆菌或阴道拭子来恢复,而且即使有作为益生菌销售的拟杆菌属活菌株,它们也可能无法完全替代婴儿自然接收的特定母体菌株。因此,接种足月婴儿肠道最自然和最经济有效的方法是使婴儿暴露于母体肠道细菌,正如我们在这项概念验证研究中所显示的。
儿科免疫系统相关疾病以及肥胖和代谢疾病在全球范围内的发病率正在增加,对公共卫生造成了重大负担。尽管因果关系尚未得到证实,但许多这样的慢性疾病都与剖腹产有关,很可能至少部分是由于婴儿暴露于异常的菌群信号所导致的(Stiemsma and Michels, 2018)。肠道菌群与宿主不断地相互作用,向宿主发出信号并影响代谢和免疫功能。微生物信号被认为在早期发育阶段尤其重要,因为这时免疫系统正在形成。事实上,小鼠实验表明,肠道菌群可能影响表观遗传编程(Pan et al., 2018),指导免疫系统的发育(Gensollen et al., 2016),并影响生长和能量代谢(Blanton et al., 2016)。在剖腹产婴儿中成功恢复正常的垂直菌群转移和随年龄相关的菌群发育,可能对这些婴儿的长期健康有广泛的影响。
本文翻译自:
Korpela et al., Maternal Fecal Microbiota Transplantation in Cesarean-Born Infants Rapidly Restores Normal Gut Microbial Development: A Proof-of-Concept Study 2020, Cell 183, 324–334